发酵粉是一种化学膨松剂,可由小苏打、臭粉(碳酸氢铵)、明矾中的两种物质组成。某小组为探究不同品牌的发酵粉的化学成分,进行如下实验。
【提出假设】
(1)假设1:由小苏打和臭粉组成 假设2:由小苏打和明矾组成 假设3:由______组成
【方案与流程】
为探究甲品牌的发酵粉的成分,某同学设计如下实验,得到如下现象:
(2)结合步骤①~③分析,气体A为__ __,该发酵粉的成分为_ _ (填化学式)。
(3)乙品牌的发酵粉的化学组成可能为假设2情况,请你设计实验验证。
实验仪器和用品任选,限选试剂:稀盐酸、0.1mol/LnaOH溶液
写出实验步骤、预期现象和结论。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量样品溶于足量的盐酸后,将溶液分成两份,分别装入A、B试管中。 |
|
| 步骤2: |
焰色呈黄色证明有Na+,发酵粉中有NaHCO3 |
| 步骤3: |
看到有白色沉淀生成(或先产生白色沉淀后沉淀溶解),证明发酵粉中有明矾。 |
根据下图所示实验,填空和回答问题。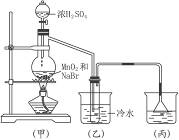
(1)烧瓶中所发生的主要反应的化学方程式是___________;装置(乙)的烧杯中冷水所起的作用是___________;装置(丙)的烧杯中液体的作用是___________。
(2)进行此实验时,烧杯内的橡皮塞最好用铝箔包住,用橡皮管连接的两玻璃管口要相互紧靠,这是因为___________,装置(丙)的烧杯中使用倒置漏斗可防止液体倒吸,其原因是___________。
某校化学兴趣小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置如图4-3所示。
图4-3
(1)写出该反应的化学方程式: 。
(2)上述反应中,还原剂是 ,若有1 mol氧化剂参加反应,转移的电子的物质的量是 mol。
(3)实验开始前,某学生对装置进行了气密性检查。方法:连接好装置后,用弹簧夹夹
住 (填“A”或“B”)处橡皮管;向分液漏斗中加水并打开活塞,当加到一定量时,停止加水,静置观察,当观察到分液漏斗中 时,表明该装置不漏气。
(4)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中错误的是(填序号) 。
A.氢氧化钠溶液
B.碳酸钠浓溶液
C.浓硫酸
用滴管将新制的饱和氯水慢慢滴入含酚酞的NaOH稀溶液中,当滴到最后一滴时红色突然褪去。试完成下列问题:
(1)产生上述现象的原因可能有两种,请用简要的文字说明:
①____________________________________________。
②____________________________________________。
(2)简述怎样用实验证明红色褪去的原因是①还是②:______________________________。
实验室用浓盐酸、MnO2共热制Cl2,并用Cl2和Ca(OH)2反应制少量漂白粉,现已知反应:2Cl2+2Ca(OH)2====Ca(ClO)2+CaCl2+2H2O,温度稍高即发生副反应:6Cl2+6Ca(OH)2
Ca(ClO3)2+5CaCl2+6H2O。现有三个同学分别设计的三套实验装置如图所示: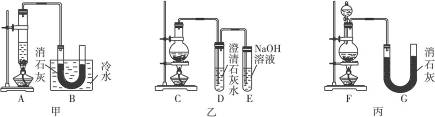
(1)a.不容易控制反应速率,b.容易控制反应速率,c.有副反应发生,d.可防止副反应发生,e.污染环境,f.可防止污染环境,请从这几个方面对上述甲、乙、丙三套装置的优缺点作出评析,并选择符合题目要求的选项填在空格内。
| 优点 |
缺点 |
|
| 甲装置 |
||
| 乙装置 |
||
| 丙装置 |
(2)上述装置中,甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G两部分组成,请从上述装置中,选取合理的组成部分,组装一套较完善的实验装置,装置各部分的连接顺序(按气流从左到右的方向)是__________________。
(3)实验室中若用12 mol·L-1的浓盐酸100 mL与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总是__________0.15 mol(填“大于”“小于”或“等于”),其原因是(假定各步反应均无反应物损耗,且无副反应发生)________________________。
实验室里化学试剂的保存方法是不相同的,下图中A、B、C、D是常见的一些保存药品的试剂瓶。请把下列常见试剂的序号填写在各试剂瓶下面的括号内:①浓硫酸②碳酸钠溶液③大理石④酒精⑤氯水⑥浓硝酸
| A |
B |
C |
D |
 |
 |
 |
 |
| () |
() |
() |
() |