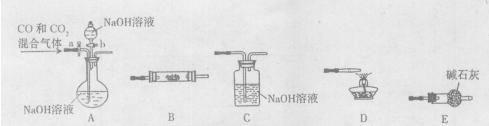
氯气是一种重要的化工原料,在生产和生活中的应用十分广泛。
(1)请写出实验室用二氧化锰和浓盐酸共热制取氯气的化学方程式。
(2)实验室欲制得氯气1.12 L,理论上需要消耗二氧化锰多少克?
(3)①若用3.36 L 氯气与4.0 mol/L的NaOH溶液反应制取简易消毒液,则需要多少毫升这种NaOH溶液能与氯气恰好完全反应?
②实验发现,该反应产物的质量明显小于理论值,可能的原因是
。
Ⅰ、有一学生在实验室测某溶液的pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒醮取试样进行检测。
(1)该学生的操作是 (填“正确的”或“错误的”)。
(2)如不正确,是否一定有误差?答: (填“是”或“否”)
(3)若按此法分别测定C(H+)相等的盐酸和醋酸溶液的pH,误差较大的是 ,原因是 。
Ⅱ、
(1)如图表示50mL滴定管中液面的位置,其读数是 mL
(2)乙二酸俗名草酸,某化学学习小组的同学欲探究测定
|
草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+ 2Mn2++10CO2↑+8H2O该组同学设计了滴定的方法测定x值。请回答:
某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验制取氨气的化学方程式 ;
(2)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气。你认为他能否达到目的? (填“能”或“否”),理由是 。
(二)该小组中某同学设计了如下图所示的实验装置(部分夹持及尾气处理装置未画出),探究氨气的还原性: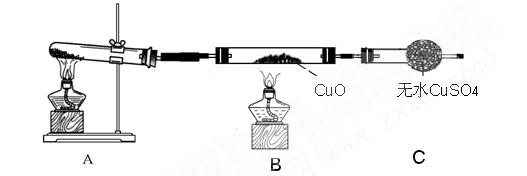 (3)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是
(3)该装置在设计上有一定缺陷,为保证实验结果的准确性,对该装置的改进措施是
(4)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体。写出氨气与CuO反应的化学方程式 。
(三)问题讨论
(5)有同学认为:NH3与CuO反应生成的红色物质可能含有Cu2O。已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+ 的稳定性比Cu2+ 差(Cu+ Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O 。
Cu+Cu2+)。请你设计一个简单的实验检验该红色物质中是否含有Cu2O 。
(6)解决了问题(5)后,有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变为红色粉末A。冷却后称量,A的质量为72 g。据此可推得,A的化学式为 。由此,得到的结论是________________________________。
(7分)某工业纯碱中含有少量NaCl和NaOH。学生课外活动小组为测定其中Na2CO3的质量分数,采样进行分析。通过集体讨论,选择下列适当装置连接,对设计方案不断完善,成功地完成了测定实验。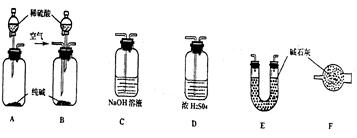
下面是甲、乙、丙、丁、戊五位同学有关设计实验装置的讨论发言。请在空白处填写他们的发言内容:
甲: 将装置A和E连接即可。因为Na2CO3与稀硫酸反应生成的CO2被E中的碱石灰吸收,通过分别测量反应前和反应后E的总质量,可求出Na2CO3的质量分数。
乙: 还应在A和E之间连接装置_____(填序号),其目的是: _________________________
丙:应该用B装置取代A。从B装置的导管口处缓缓鼓入空气,其目的是:
_______________________________________________________________
丁: 由于空气中含有CO2,若直接向B装置鼓入空气会导致实验测定结果__________(填“偏高”、“偏低”或“无影响”)。因此,应将鼓入的空气先通过装置________。
戊: E装置后还应连接装置F,其作用是___________________________________________
学生课外活动小组测定的数据如下:
计算该工业纯碱中Na2CO3的质量分数为: ___________
[探究实验一]某同学探究同周期主族元素性质递变规律时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系):
| 实验步骤 |
实验现象 |
||||
| 1.将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 |
|
||||
| 5.将铝条投入稀盐酸中 |
E.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:探究同周期主族元素性质递变规律。
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液。仪器:① ,② ,③ ,试管夹,镊子,小刀,玻璃片,砂纸,酒精灯等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和离子方程式)
| 实验内容 |
实验现象 |
离子方程式 |
| 1 |
||
| 2 |
||
| 3 |
||
| 4 |
||
| 5 |
(4)若用最高价氧化物的水化物的碱性相对强弱来验证Mg、Al失电子能力的强弱,请你设计实验(实验用品自选,不要求写化学方程式):
;
(5)实验结论: ;
[探究实验二]一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应
的催化剂。为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化
效果的影响,设计如下对比实验:
| 实验 序号 |
氯化镁固体中氯元素含量/% |
温度/℃ |
粉碎方式/ |
催化效果/g·g-1 |
| 1 |
70.97 |
20 |
滚动球磨 |
3.9×104 |
 2 2 |
74.45 |
20 |
滚动球磨 |
5.0×104 |
| 3 |
74.45 |
20 |
振动球磨 |
5.9×104 |
| 4 |
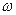 |
100 |
振动球磨 |
(注:催化效果用单位时间内每克催化剂得到产品的质量来表示)
(6)表中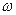 = ;
= ;
(7)从实验1、2可以得出的结论是: ;
(8)设计实验2、3的目的是: 。
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量的氧化铁杂质。具体实验流程如下:
请回答下列问题:
(1)操作l所用到的玻璃仪器的名称是。
(2)由溶液3制取氢氧化铝的离子方程式为。
(3)明矾石焙烧时产生SO2气体,请你写出能验证SO2气体具有还原性且实验现象明显的化学方程式。
(4)请你写出验证溶液l中有NH4+的实验过程。
(5)实验室用Fe2O3与CO反应来制取单质Fe。
①请你按气流由左到右方向连接下列各装置,顺序为:A→。
②检验装置A气密性的方法是。
③在点燃B处的酒精灯前,应进行的操作是。
④装置C的作用是。