如图所示是某弹簧振子的振动图像,由图像可知,该振子振动的频率是___________ Hz,0-0.3s内振子运动的路程为___________m。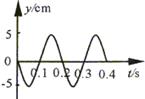
如图所示为氢原子的能级图。用光子能量为13.06 eV的光照射一群处于基态的氢原子,可能观测到氢原子发射的不同波长的光有 种,其中最短波长为 m(已知普朗克常量h=6.63×10-34 J·s)。
如图甲所示,为一列沿水平方向传播的简谐横波在t=0时的波形图,图乙是这列波中质点p的振动图线,下列说法正确的是
| A.该波的波长为1.5m |
| B.该波的振幅为0.2cm |
| C.该波的传播速度为0.5 m/s |
| D.该波的传播方向向右 |
E.Q点(坐标为x=2.25 m处的点)的振动方程为可能是:y=0.2cos πt cm
关于固体与液体,下列说法正确的是
| A.由于液体表面分子间距离大于液体内部分子间的距离,液面分子间只有引力,没有斥力,所以液体表面具有收缩的趋势 |
| B.液晶既具有液体的流动体,又具有光学各向异性 |
| C.不具有规则几何形状的物体一定不是晶体 |
| D.有的物质能够生成种类不同的几种晶体,因为它们的物质微粒能够形成不同的空间结构 |
E.所有晶体都有固定熔点
下列说法正确的是________
| A.根据玻尔理论,氢原子在辐射一个光子的同时,轨道也在连续地减小 |
| B.用能量等于氘核结合能的光子照射静止氘核,不可能使氘核分解为一个质子和一个中子 |
| C.放射性物质的温度升高,则半衰期减小 |
| D.某放射性原子核经过2次α衰变和一次β衰变,核内质子数减少3个 |
E、根据玻尔理论,氢原子的核外电子由较高能级跃迁到较低能级时,要示范一定频率的光子,同时电子的动能增大,电势能减小
事实证明:机械波在均匀介质中传播是有能量损失的,距离波源越远振动能量越小,今位于坐标原点的波源从平衡位置沿y轴正方向开始做简谐振动,周期为T,振幅为A,该波源产生的简谐横波不断地沿x轴正向传播,波长为 ,波速为v,由于波传播过程中有能量损失,一段时间后,该波传播至某质点p,下列关于质点p振动的说法正确的是_______
,波速为v,由于波传播过程中有能量损失,一段时间后,该波传播至某质点p,下列关于质点p振动的说法正确的是_______
| A.开始振动时的振幅为A,以后振幅逐渐减小 |
| B.开始振动时振幅小于A,以后振幅不变 |
| C.开始振动时周期为T,以后周期逐渐减小 |
| D.开始振动的方向沿y轴正方向 |
E、质点p可视为新波源,由质点P振动产生的简谐横波的波长仍为 ,波速仍为v
,波速仍为v