下列说法正确的是( )
| A.把100mL 3mol·L-1的H2SO4跟100mLH2O混合,硫酸的物质的量浓度变为1.5mol·L-1 |
| B.把100g 20%的NaCl溶液跟100g H2O混合后,NaCl溶液的质量分数是10% |
| C.把200mL 3mol·L-1的BaCl2溶液跟100mL 3mol·L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3mol·L-1 |
| D.把100mL 20%的NaOH溶液跟100mL H2O混合后,NaOH溶液的质量分数是10% |
3、下列物质在水处理过程中肯定不会用到的是
| A.KAl(SO4)2•12H2O | B.Cl2 | C.Ca(ClO)2 | D.KNO3 |
2、无色难溶于水的气体是
| A.SO2 | B.NO | C.NH3 | D.NO2 |
1、下列属于物理变化的是
| A.氯气溶于水 | B.食物变质 | C.焰色反应 | D.光合作用 |
绿色化学对化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的原子经济性反应是原料分子中的原子全部转变成所需产物,不产生副产物、实现零排放。下列几种生产乙苯(C6H5-C2H5)的方法中,原子经济性最好的是
A.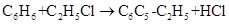 |
B. |
C.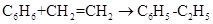 |
D.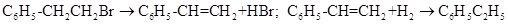 |
在乙烯分子中有5个σ键和一个π键,它们分别是
| A.sp2杂化轨道形成σ键,未杂化的2p轨道形成π键 |
| B.sp2杂化轨道形成π键,未杂化的2p轨道形成σ键 |
| C.C—H之间是sp2杂化轨道形成σ键,C—C之间只有未杂化的2p轨道形成π键 |
| D.C—C之间是sp2杂化轨道形成σ键,C—H之间是未杂化的2p轨道形成π键 |