已知可逆反应aA(g)+bB(?)  cC(g) ΔH>0(B物质的状态未确定)。关于该反应的描述正确的是( )
cC(g) ΔH>0(B物质的状态未确定)。关于该反应的描述正确的是( )
| A.加压若平衡正向移动,则a>c |
| B.加入一定量的B,平衡一定正向移动 |
| C.缩小容器的体积,各物质的浓度一定增大 |
| D.升高温度,平衡一定正向移动,混合气体的平均摩尔质量的变化不能确定 |
对于化学反应:N2(g)+O2 (g) 2NO(g),在密闭容器中,下列条件的改变引起该反应的反应速率的变化是什么(填在横线上)。
2NO(g),在密闭容器中,下列条件的改变引起该反应的反应速率的变化是什么(填在横线上)。
| A.缩小体积使压强增大_________。 |
| B.体积不变充入N2使压强增大_________。 |
| C.体积不变充入氩气使压强增大_________。 |
| D.压强不变充入氩气使体积增大_________。 |
E.增大体积使压强减小_________。
对于在密闭容器中进行的反应:N2+O2 2NO,下列不能加快该反应的反应速率的条件是()
2NO,下列不能加快该反应的反应速率的条件是()
| A.缩小体积 |
| B.充入更多的NO |
| C.体积增大到原来的2倍 |
| D.升高温度 |
在容积为2 L的密闭容器中,发生如下可逆反应:mA(g)+nB(g) pC(g)+qD(g),经过5 min达到平衡,此时A的浓度减少a mol·L-1,B的平均反应速率为
pC(g)+qD(g),经过5 min达到平衡,此时A的浓度减少a mol·L-1,B的平均反应速率为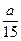 mol·L-1·min-1,C的浓度增加
mol·L-1·min-1,C的浓度增加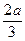 mol·L-1,这时若增加系统压强,发现A与C的百分含量不变,则m∶n∶p∶q为()
mol·L-1,这时若增加系统压强,发现A与C的百分含量不变,则m∶n∶p∶q为()
| A.3∶1∶2∶2 | B.1∶3∶2∶2 |
| C.1∶3∶2∶1 | D.1∶1∶1∶1 |
把Zn粒放入盛有稀盐酸的容器中,产生H2的速率与下列因素无关的是()
| A.盐酸的浓度 | B.溶液的温度 |
| C.Zn颗粒的大小 | D.溶液中Cl-的浓度 |
甲、乙两容器中都在进行A B+C的反应,甲中每分钟减少4 mol A,乙中每分钟减少2 mol A,则甲、乙两容器中的反应速率的比较是()
B+C的反应,甲中每分钟减少4 mol A,乙中每分钟减少2 mol A,则甲、乙两容器中的反应速率的比较是()
| A.甲快 | B.乙快 |
| C.相等 | D.无法确定 |