下列实验中,利用了盐酸的氧化性的是( )
| A.用盐酸除去铜粉中混有的铁粉 | B.用浓盐酸和MnO2制氯气 |
| C.用盐酸跟氢氧化钠溶液反应 | D.盐酸和硝酸银溶液反应生成白色沉淀 |
A、B、C三种醇分别与足量的金属钠完全反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3∶6∶2,则A、B、C三种醇分子里羟基数之比是:
A.3∶2∶1 B.2∶6∶3
C.3∶1∶2 D.2∶1∶3
为了探究金属腐蚀的条件和快慢,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如下图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是: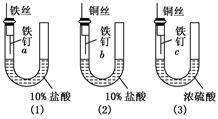
| A.实验结束时,装置(1)左侧的液面一定会下降 |
| B.实验结束时,装置(1)左侧的液面一定比装置(2)的低 |
| C.实验结束时,铁钉b腐蚀最严重 |
| D.实验结束时,铁钉c几乎没有被腐蚀 |
下列关于性质递变规律的叙述错误的是:
| A.酸性H2SO4>H3PO4>HClO4 | B.还原性Na>Mg>Al |
| C.氧化性Cl>S>P | D.稳定性HCl>H2S>PH3 |
氢气在氧气中燃烧时产生淡蓝色火焰。在反应过程中,破坏1 mol氢气中的化学键消耗的能量为Q1 k J,破坏1 mol O2中的化学键消耗的能量为Q2 k J,形成1 mol H2O中的化学键释放的能量为Q3 k J。下列关系式中,正确的是:
| A.Q1+Q2 > Q3 | B.2Q1+Q2 > 2Q3 | C.2Q1+Q2 < 2Q3 | D.2Q1+Q2=2Q3 |
沼气的主要成分是CH4。0.5 mol CH4完全燃烧生成CO2和液态水时,放出445kJ热量。下列热化学方程式中,正确的是:
| A.2CH4(g)+4O2(g)=2CO2(g)+4H2O(l) △H=+890kJ/mol |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=+890kJ/mol |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol |
| D.1/2 CH4(g)+ O2(g)=1/2CO2(g)+ H2O(g) △H=-890kJ/mol |