反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率v(X)(反应物的消耗速率或生成物的生成速率)可表示为( )
4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率v(X)(反应物的消耗速率或生成物的生成速率)可表示为( )
| A.v(NH3)=0.010 mol·(L·s)-1 | B.v(O2)=0.001 mol·(L·s)-1 |
| C.v(NO)="0.001" 0 mol·(L·s)-1 | D.v(H2O)=0.045 mol·(L·s)-1 |
某有机物含有C、H、O三种元素,其球棍模型如图所示。该有机物可能发生的反应有①水解②加聚③取代④消去⑤银镜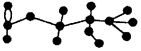
A.①②③④⑤ B.①③④⑤
C.①③④ D.①④⑤
下列说法正确的是
| A.苯乙烯分子中所有原子可能在一个平面上 |
B.分子式为 且分子中有苯环的有机物共有4种 且分子中有苯环的有机物共有4种 |
| C.甲酸分子中有醛基,因此无法区别甲醛溶液和甲酸溶液 |
| D.除去乙烯中混有的甲烷,可将混合气体通过酸性高锰酸钾溶液 |
下列实验中,有关仪器的下端必须插入液面以下的是
①制备乙烯时用的温度计;②制备氯气装置中的分液漏斗;③制取氨水时氨气溶于水的导管;④制备氢气的简易装置中加入稀硫酸用的长颈漏斗;⑤分馏石油时的温度计;⑥制备乙酸乙酯时,将乙酸乙酯蒸气通入饱和Na2CO3溶液的导管。
| A.①②④ | B.①④ | C.①②③⑥ | D.①②③④ |
短周期元素X、Y、Z和W的原子序数依次递增,且在同一周期,四种元素原子的最外层电子数之和为19,X和Y元素原子的原子序数比6:7,X的最高正价是W的最低负价的绝对值的2倍。下列说法正确的是
| A.X单质可以通过铝热法获得 | B.Y的氧化物是良好的半导体材料 |
| C.Z的氢化物比W的氢化物更稳定 | |
| D.X的最高价氧化物和Z的最高价氧化物化合的产物中有共价键和离子键 |
下列各条件下可能共存的离子组是
A.某无色溶液中:NH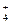 、Na+、Cl-、MnO 、Na+、Cl-、MnO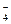 |
| B.在含有大量I-离子的溶液中:Cl¯、Fe3+、Al3+、Cu2+ |
C.在c(H+)=1×10-13mol·L-1的溶液中:NH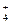 、Al3+、SO 、Al3+、SO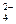 、CO 、CO |
| D.在加入Al能放出大量H2的溶液中:NH4+、SO42¯、C1¯、Na+ |