用中和滴定的方法测定NaOH和Na2CO3混合溶液中NaOH的含量时,可先在混合溶液中加入过量的氯化钡溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂)。试完成下列问题:
(1)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,为什么不会使BaCO3溶解而能测定NaOH的含量?_______________________________________________________________________。
(2)滴定终点时溶液颜色如何变化?______________________________________________。
(3)滴定时,若滴定管中滴定液一直下降到活塞处才到达终点,能否据此得出准确的滴定结果_______________(填“能”或“不能”)。
(4)能否改用甲基橙作指示剂(填“能”或“不能”) _______________,如果用甲基橙作指示剂,则测定结果如何?_______________(填“偏高”“偏低”或“正确”)。
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于晶体;基态Ni原子的电子排布式为。
(2)配合物分子内的作用力有(填编号)。
| A.氢键 | B.离子键 | C.共价键 | D.金属键 E.配位键 |
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如
①CH2=CH2、②CH≡CH、③苯、④HCHO等,
其中分子属于平面结构的有(填物质序号),预测HCHO分子的立体结构为形。
(4)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上。该晶体的化学式为。
(14分) 复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀法生产Fe3O4的工艺: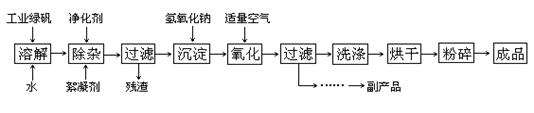
已知:①工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
② Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O
③ 12.16﹡1000﹡52.5%=6384,6384/152=42请回答下列问题:
(1)铁的常见氧化物有;
(2)Fe3O4与稀硝酸反应的离子方程式是,检验反应后的溶液中含Fe3+的方法;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是:;
(4)生产中可获得的副产品是,提取该副产品的操作顺序是(填写序号)
a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16 kg/h,为使产品较纯,鼓入空气的速率应为L/h(假设反应在标准状态下进行,空气中O2占20%)。
短周期常见元素形成的纯净物A、B、C、D、E转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同)。
请回答下列问题:
(1)若A为金属,C是离子化合物,D是一种强碱,写出A的离子结构示意图。C的化学式。D与等物质的量醋酸反应所得溶液的PH____________7,(填﹥,﹤,=)。原因是(用文字和离子方程式说明)。
(2)若C是一种气体,D是一种强酸,则:
①C与水反应的化学方程式为。
②有人认为“浓H2SO4可以干燥气体C”。某同学为了验证该观点是否正确,用下图装置进行实验。实验过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的结论是。
③已知常温下1 mol气体C与H2O反应生成D溶液和E气体放出46kJ热量,写出气体C与H2O反应生成D溶液和E气体的热化学方程式。
已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系: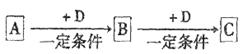
(1)若A能使湿润的红色石蕊试纸变蓝,C为红棕色气体。则实验室常用的制取A的化学方程式为,A转化为B的化学方程式为。
(2)若组成D单质的元素在地壳中含量最高,A元素焰色反应为黄色,则C的电子式为。
(3)若D是金属,C溶液在贮存时应加入少量D,其理由是(只用离子方程式说明)________________,A与D反应的化学方程式是。
(4)若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为。
(5)若D为一种强碱,B具有两性,则C溶液中除氢氧根外还存在的阴离子的化学式为。
四种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。请回答下列问题:
| X |
Y |
|
| Z |
W |
(1)元素Z位于周期表中第周期,族;
(2)这些元素的氢化物中是结构最简单的有机物(写化学式);
(3)Y的最高价氧化物的化学式为;
(4)XW2的电子式为;其遇水在高温时发生非氧化还原反应,得到两种酸性气体,该反应的化学方程式为:
(5)用电子式表示Na2W的形成过程;
(6)W和Y形成的一种化合物相对分子质量在170~190之间,且W的质量分数约为70%。该化合物的化学式为。