现有以下四种物质:
| A.新制的氢氧化铜[Cu(OH)2]悬浊液 | B.碳铵(NH4HCO3) |
| C.明矾[ KAI(SO4)2·12H2O] | D.熟石灰[Ca(OH)2] |
请你根据题意,选择恰当的选项用字母代号填空。
(1)检验尿液中是否含有葡萄糖,可使用 ;
(2)要使含泥沙的河水变澄清,可使用 ;
(3)要中和钢铁厂、电镀厂产生的酸性废水,可使用 ;
(4)给农作物施用氮肥,可使用 。
(1)臭氧层是地球生命的保护神,其中的臭氧O3和O2是氧元素的两种单质,在同温同压下,相等质量的氧气和臭氧,它们的物质的量之比为________,分子个数比为________,原子个数比为________。
(2)在一密闭容器中充入a mol NO和b mol O2,可发生如下反应:2NO+O2===2NO2,充分反应后容器中氮原子和氧原子的个数之比为_________________。
有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、NaCl等混合组成,为了检验它们所含的物质,做了以下实验。
①将固体溶于水,搅拌后得到无色透明溶液;
②往此溶液中滴加硝酸钡溶液,有白色沉淀生成;
③过滤,将沉淀置于稀硝酸中,发现沉淀全部溶解。
(1)试判断:固体混合物中肯定含有_________,肯定没有__________,可能含有__________。
(2)对可能有的物质,可采用往滤液中滴加___________________(填试剂名称)来检验,如果含有该物质,其现象是____________________。
下列物质中,属于电解质的是________,属于非电解质的是_______,属于电解质溶液的是__________。(填序号)
| A.氯化钠; | B.硫酸; | C.酒精溶液; | D.氢氧化钠;E、铜;F、蔗糖;G、硝酸钠溶液;H、硫酸钡。 |
有以下几个反应:
①CO2+2KOH=K2CO3+H2O;
②2FeCl2+Cl2=2FeCl3;
③2NaHCO3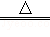 Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
④CaCO3+H2O+CO2=Ca(HCO3)2;
⑤Cu+2FeCl3=CuCl2+2FeCl2.
其中属于氧化还原反应的是__________。
(1)酸、碱、盐在溶液中发生复分解反应,通常有__________、___________或_________等难电离物质生成。
(2)在温度和压强一定时,物质的体积主要由___________________________________、_______________________________、_______________________________________决定。