对化学平衡移动的分析,下列说法不正确的是
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物的物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物的物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③改变外界条件使正反应速率大于逆反应速率时,化学平衡向正反应方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡不一定移动
| A.①④ | B.①③ | C.②③ | D.①② |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.在pH=1的溶液中:K+、Na+、SO42–、HCO3- |
| B.在0.1 mol·L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42– |
| C.在0.1 mol·L-1 FeCl3溶液中:K+、NH4+、I-、SCN- |
| D.在c( H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO3- |
下列实验中,所采取的分离方法与对应原理都正确的是
| 选项 |
目的 |
分离方法 |
原理 |
| A. |
分离氢氧化铁胶体和氯离子 |
盐析 |
胶体不能透过半透膜,离子能 |
| B. |
分离植物油和水的混合物 |
分液 |
二者互不相溶且沸点不同 |
| C. |
除去苏打中少量小苏打 |
加热 |
二者的溶解度不同 |
| D. |
除去乙醇中的乙酸 |
蒸馏 |
乙醇与乙酸沸点相差较大 |
下列有关实验的叙述中正确的是
| A.用烧杯或烧瓶给液体物质加热时,没有垫石棉网 |
| B.酒精和浓硫酸混合共热至170 ℃,可制得乙稀 |
| C.用托盘天平称量固体药品时,药品放在右盘上 |
| D.如果未知溶液中滴加氯化钡溶液有白色沉淀生成,证明原溶液中一定含有硫酸根离子 |
标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.1 L水中,所得溶液密度为ρ g/mL,则此溶液物质的量浓度为
A. mol/L mol/L |
B. mol/L mol/L |
C.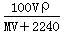 mol/L mol/L |
D. mol/L mol/L |
NA代表阿伏加德罗常数,下列说法正确的是
| A.同温同压下,相同体积的任何气体单质所含的原子数相同 |
| B.1 mol过氧化钠中阴离子所带的负电荷数为2NA |
| C.常温常压下,11.2 L氮气所含的原子数目为NA |
| D.某温度时,pH=6的纯水中,含10-6NA个OH- |