下列化学反应的离子方程式正确的是:
| A.氯化铁溶液中加入铁粉: Fe3+ + Fe = 2Fe2+ |
| B.氯化亚铁溶液中通入氯气: 2Fe2+ +Cl2=" 2" Fe3+ + 2Cl - |
| C.AlCl3溶液中加入过量氨水: Al3++4OH- = AlO2-+2H2O |
| D.实验室用大理石和稀盐酸制取CO2:2H+ + CO32- = CO2↑+ H2O |
在T℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,其中含NH4+的物质的量为b mol。下列叙述中正确的是( )
A.溶质的质量分数为w=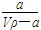 ×100% ×100% |
B.溶质的物质的量浓度c=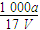 mol·L-1 mol·L-1 |
C.溶液中c(OH-)= mol·L-1 mol·L-1 |
| D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w |
下列实验操作或对实验事实的叙述正确的有几个:()
①用氨水清洗做过银镜反应的试管;
②配制一定物质的量浓度的溶液时,定容时仰视则溶液浓度偏低。
③用湿润的pH试纸测定稀盐酸的pH;
④用碱式滴定管量取20.00 mL 0.1mol/LKMnO4溶液
⑤将Na2CO3固体在瓷坩埚中加热熔融;
⑥不慎将苯酚溶液沾到皮肤上,立即用NaOH稀溶液清洗
⑦向沸腾的NaOH溶液中滴加FeCl3溶液,制备Fe(OH)3胶体
⑧配制FeSO4溶液时,需加入少量铁粉和稀硫酸
| A.5 | B.3 | C.2 | D.1 |
2012年6 月24日午间,神九与天宫一号顺利完成了我国首次手控交会对接,神九火箭中使用的燃料是偏二甲肼(CH3-NH-NH-CH3)和四氧化二氮(N2O4)。在火箭升空过程中,燃料发生反应:CH3-NH-NH-CH3+2N2O4→2CO2+3N2+4H2O提供能量。下列有关叙述正确的是()
| A.该燃料绿色环保,在燃烧过程中不会造成任何环境污染 |
| B.该反应中N2O4是氧化剂,偏二甲肼是还原剂 |
| C.CO2是氧化产物,N2是还原产物 |
| D.每有0.6 mol N2生成,转移电子数目为2.4NA |
已知:NA表示阿伏伽德罗常数,则下列说法正确的是()
| A.7.8 g Na2O2中所含阴离子的数目是0.2NA。 |
| B.标准状况下,4.48L氦气和重氢气(D2)的混合物中所含中子数为0.4NA, |
| C.含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1mol/L。 |
| D.足量铜与 0.1L 18.4mol·L-1浓硫酸反应,生成SO2的分子数等于0.92NA。 |
下列解析不科学的是()
| A.“水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成了可溶性的Ca(HCO3)2的缘故。 |
| B.长期盛放NaOH溶液的滴瓶不易打开,是因为NaOH与瓶中的CO2反应导致瓶内气体减少形成“负压”的缘故。 |
| C.严格地讲,“通风橱”是一种不负责任的防污染手段,因为实验产生的有害气体没有得到转化或吸收。 |
| D.“雨后彩虹”、“海市蜃楼”既是一种自然现象又是光学现象,也与胶体的知识有关。 |