人类的生产生活离不开金属,下列三种金属被发现、使用的先后顺序依次为:铜、铁、铝.
(1)金属大规模被使用的先后顺序跟 (填序号)选项关系最大.
①地壳中金属元素的含量;②金属的导电性;③金属的活动性.
(2)为探究锰与铁的金属活动性,在相同温度下,取大小相同、表面光亮的两种金属薄片,分别投入等体积、等溶质质量分数的足量稀盐酸中(反应中Mn显+2价),请回答:
| 金属 |
铁 |
锰 |
| 与盐酸反应现象 |
放出气泡速率缓慢 |
放出气泡速率较快 |
| 结论 |
活动性铁 < (填“>”“<”)锰 |
除了比较与酸反应产生气体速率的快慢,请你再举出一种可比较这二种金属活动性强弱的方法(写出所需药品即可): .
(3)将盛有等质量、等溶质质量分数的稀盐酸的两只烧杯,放在托盘天平左右两盘上,调节至平衡,再向两只烧杯中分别放入质量相等的镁和铁,待反应停止后,请判断:
①若天平仍保持平衡,烧杯中一定没有剩余的物质是 ;
②若天平失去平衡,则指针一定偏向放 的一边.
2011年3月10日云南盈江县发生5.8级地震,震后当地生态环境和生活条件受到极大的破坏,水源受到一定程度的污染。灾区饮用水安全备受关注。
(1)向水样中加入明矾,经溶解、静置、(填操作名称),除去不溶性杂质,然后加入活性炭,利用其性除去异味,再杀菌消毒,得到生活用水。
(2)欲判断得到的生活用水是硬水还是软水,可加入进行检验,生活中常通过的方法降低水的硬度。
(3)当你身处在地震灾区时,水资源受到严重污染,必须经过净化处理后才能饮用。下列各项与水的净化过程无关的是(填标号)。
| A.吸附 | B.消毒 | C.电解 | D.过滤 |
小明做了一个趣味实验如图所示(装置气密性良好):
(1)写出A试管中发生反应的化学方程式;
反应类型是;
(2)待试管冷却至室温,在水中取下胶塞,试管中液面上升(如图B所示)。
其原因是。
元宵节是我国的重要传统节日,“接汉疑星落,依楼似月悬。”是唐代著名诗人卢照邻对其盛况的写照,我国许多地方至今仍保留着燃灯放焰、共吃元宵的风俗。
(1)某红焰烟花的配方中包括硫、木炭粉、硝酸锶[Sr(NO3)2]等。
硝酸锶中Sr的化合价为;
(2)燃放孔明灯(如图)祈福成为了元宵节的新风尚。小新同学想自制孔明灯,为了使它能飞得更高、更远、更安全,选择作为灯罩的材料应质轻且;选择的燃料应燃烧热值大且。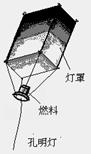
洋洋同学从与医生的交谈中获悉:正常人每分钟约呼吸30次,每次约吸入0.4L空气,请问一个人一昼夜吸入体内的氧气约为_____升?(以空气中氧气的体积分数是21%计算,计算结果保留整数)
下列是初中化学常见的仪器和装置,请回答相关问题。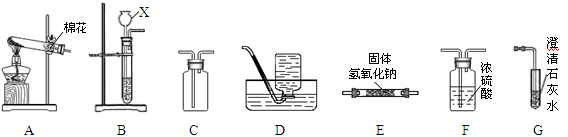
(1)B装置中仪器X的名称:X是。
(2)若将装置A和D(药品为高锰酸钾)连接制取并收集氧气,其中装置A中的试管口略向下倾斜的目的是。
(3)实验室用大理石和稀盐酸制取并收集一瓶干燥的二氧化碳,同时检验二氧化碳。按照气流自左至右方向流动,所用仪器按连接顺序依次为(填字母顺序)。