短周期主族元素A、B、C、D,原子序数依次增大。A、B、C三种元素原子的最外层电子数之和为15,A、C的原子序数的差为8,A原子最外层电子数等于B原子最外层电子数的2倍。下列叙述正确的是
A.原子半径:A<D<C<B
B.非金属性:C>D
C.氢化物的热稳定性:C>A
D.单质B常温下能溶于浓硝酸但不能溶于氢氧化钠溶液
为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=1g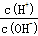 。则下列叙述不正确的是
。则下列叙述不正确的是
| A.中性溶液的AG=0 |
| B.碱性溶液的AG>0 |
| C.AG越大碱性越强,酸性越弱 |
| D.常温下0.1mol·L-1氢氧化钠溶液的AG=-12 |
下列各种溶液中,可能大量共存的离子组是
| A.pH=0的溶液中:Fe2+、NO3-、SO42-、I- |
| B.由水电离出的c(OH-)=1×10-13mol·L-1的溶液中:Na+、[Al(OH)4]-、S2-、CO32- |
| C.含有大量Fe3+的溶液中:Na+、I-、K+、NO3- |
| D.c(H+)=10-14mol·L-1的溶液中:Mg2+、NO3-、Fe2+、ClO- |
常温下,关于溶液的稀释说法正确的是
| A.将1 L 0.1mol·L-1的Ba(OH)2溶液加水稀释为2L,pH=13 |
| B.pH=3的醋酸溶液加水稀释100倍,pH=5 |
| C.pH=4的H2SO4加水稀释100倍,溶液中由水电离产生的[H+]=1×10-6mol·L-1 |
| D.pH=8的NaOH溶液加水稀释100倍,其pH=6 |
下图是恒温下某反应的化学反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是
| A.反应达平衡时,正反应速率和逆反应速率相等 |
| B.该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ |
| C.该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ |
| D.同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。则下列说法正确的是
| A.电池工作时,MnO2发生还原反应 |
| B.电池负极的电极反应式为:2MnO2+H2O+2e-→Mn2O3+2OH- |
| C.电池工作时,电路中每通过0.2mol电子,锌的质量理论上减少6.5g |
| D.电池工作时,K+移向负极 |