关于键长、键能和键角,下列说法不正确的是( )
| A.键角是描述分子立体结构的重要参数 |
| B.键长的大小与成键原子的半径和成键数目有关 |
| C.键能越大,键长越长,共价化合物越稳定 |
| D.键角的大小与键长、键能的大小无关 |
恒温恒容条件下,进行以下反应:H2(g)+Br2(g)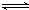 2HBr(g),已知加入 l mol H2和 2mol Br2时,达到平衡后,生成 a molHBr。在相同条件下,起始时加人H2、Br2、HBr的物质的量分别为x、y、z(均不为零),如果仍保持平衡后各组分的物质的量分数不变,则以下推断不正确的是
2HBr(g),已知加入 l mol H2和 2mol Br2时,达到平衡后,生成 a molHBr。在相同条件下,起始时加人H2、Br2、HBr的物质的量分别为x、y、z(均不为零),如果仍保持平衡后各组分的物质的量分数不变,则以下推断不正确的是
| A.达平衡时HBr物质的量一定仍为a mol |
| B.两平衡压强比为3:(x+y+z) |
| C.达平衡时HBr的物质的量为(x+y+z)a/3 |
| D.x、y、z应满足的关系是 4x+z= 2y |
某温度下,H2(g)+CO2(g)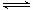 H2O(g)+CO(g)的平衡常数K=2.25。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
H2O(g)+CO(g)的平衡常数K=2.25。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2)/mol/L |
0.010 |
0.020 |
0.020 |
| c(CO2)/mol/L |
0.010 |
0.010 |
0.020 |
下列判断不正确的是
A.反应开始时,反应速率:甲<乙<丙
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,c(CO2)丙=2c(CO2)甲
D.平衡时,乙中CO2的体积分数大于60%
在一定温度下,一定体积的密闭容器中有如下平衡:H2(气)+I2(气) 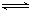 2HI(气)
2HI(气)
已知H2和I2的起始浓度均为0.1mol·L-1时,达平衡时HI的浓度为0.16mol·L-1。
若H2和I2的起始浓度均变为0.2mol·L-1,平衡时H2的浓度(mol·L-1)是
| A.0.16 | B.0.08 | C.0.04 | D.0.02 |
可逆反应N2+3H2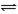 2NH3是一个放热反应。甲、乙是完全相同的容器,甲容器中加入1molN2和3 molH2,一定条件下,达平衡时放出的热量为Q1;在相同条件下,向乙容器加入2 molNH3,达平衡时,吸收的热量为Q2。已知Q2=4Q1,则甲容器中,H2的转化率
2NH3是一个放热反应。甲、乙是完全相同的容器,甲容器中加入1molN2和3 molH2,一定条件下,达平衡时放出的热量为Q1;在相同条件下,向乙容器加入2 molNH3,达平衡时,吸收的热量为Q2。已知Q2=4Q1,则甲容器中,H2的转化率
| A.20% | B.25% | C.75% | D.80% |
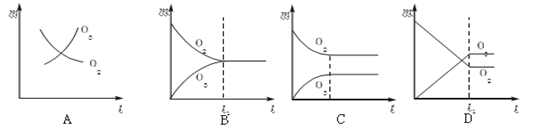
将3 mol O2加入到V L的反应器中,在高温下放电,经t1 s建立了平衡体系:3O2 2O3,此时测知O2的转化率为30%,下列图象能正确表示气体的物质的量浓度(m)跟时间(t)的关系的是
2O3,此时测知O2的转化率为30%,下列图象能正确表示气体的物质的量浓度(m)跟时间(t)的关系的是