某种混合气体可能含有N2、HCl、CO。把混合气体依次通过足量的NaHCO3溶液和灼热CuO,气体体积都没有变化。再通过足量的Na2O2固体,气体体积减小。最后通过灼热的铜网,经充分反应后气体体积又减小,但还有剩余气体。以下对混合气体组成的判断,正确的是( )
| A.一定没有N2,CO和HCl中至少有一种 |
| B.一定有N2、HCl和CO |
| C.一定有N2,CO和HCl中至少有一种 |
| D.一定有N2和HCl,没有CO |
下列溶液中离子浓度的关系正确的是()
A.0.10 mol·L-1 Na2CO3溶液:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
B.0.1 mol·L-1 NaHA溶液,其pH等于4:c(HA-)>c(H+)>c(H 2A)>c(A2-)
C.将足量的AgCl固体分别放入5 mL水和10 mL 0.1mol·L-1的NaCl溶液中溶解至饱和,溶液中Ag+浓度前者大于后者
D.相同温度下,pH=12的NaOH溶液和pH=12的CH3COONa溶液中,水的电离程度前者大于后者
已知A、B、C是单质,其中C是绿色植物光合作用的产物之一,X、Y是化合物,它们之间的转化关系如图(反应条件略),下列判断不正确的是()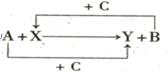
A.A 是铝,B是铁
B.A 是碳,B是硅
C.A 是氢气,B是铜
D.A 是钠,B是氢气
第三代混合动力车,可以用电动机、内燃机或二者结合作为动力。汽车在刹车或下坡时,电池处于充电状态。混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。下图是镍氢电池充放电原理的示意,其总反应式为:
下列说法中正确的是()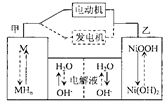
| A.混合动力车上坡或加速时,溶液中的OH-向乙电极移动 |
| B.混合动力车刹车或下坡时,乙电极周围溶液的pH增大 |
| C.混合动力车上坡或加速时,乙电极电极反应式为 NiOOH+H2O+e-=Ni(OH)2+OH- |
| D.混合动力车刹车或下坡时,甲电极电极反应式为H2+2OH-+2e- =2H2O |
用NA代表阿伏加德罗常数,下列说法正确的是()
| A.12g金刚石中所含的共价键数为4NA |
| B.标准状况下,11.2L H2O所含的分子数为0.5NA |
| C.46gNO2和N2O4的混合物含有的氮原子数为2NA |
| D.0.1mol O22-所含的电子数为1.8NA |
下列叙述正确的是()
| A.汽油、柴油和植物油都是碳氢化合物 |
| B.纤维素、淀粉、蛋白质在一定条件下都能发生水解反应 |
| C.石油的分馏和煤的干馏都是物理变化 |
| D.苯环内含有碳碳单键和碳碳双键 |