氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
| A.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。 |
| C.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。 |
| D.氨气分子是极性分子而甲烷是非极性分子。 |
下列表述不正确的是()
| A |
B |
C |
D |
 |
 |
 |
 |
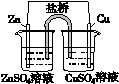
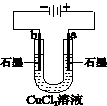
| 盐桥中的Cl-移向ZnSO4溶液 |
a极附近产生的气体能使湿润的淀粉碘化钾试纸变蓝 |
粗铜的电极反应式为: Cu2++2e-=Cu |
正极反应式为: O2+4e-+2H2O=4OH- |
如图所示装置的气密性检查中,一定漏气的是( )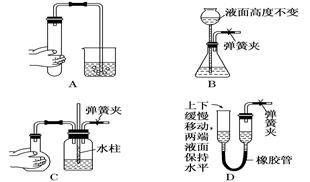
能正确表示下列反应的离子方程式是()
| A.向硫酸铜溶液中加入过量的NaHS溶液:Cu2++2HS-=CuS↓+H2S↑ |
| B.NH4Al(SO4)2溶液与足量的Ba(OH)2溶液混合: NH4++Al3++ 2SO42-+ 2Ba2++ 4OH-=2BaSO4↓ + Al(OH)3↓ + NH3·H2O |
| C.向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+ |
| D.铅酸蓄电池充电时的负极反应:PbSO4+2H2O-2e-=PbO2+4H++SO42— |
用NA表示阿伏伽德罗常数的值,下列叙述正确的是 ()
| A.标准状况下,33.6LHF中含有氟原子的数目为1.5NA |
| B.17g-OH中电子数为9NA |
| C.氢氧燃料电池正极消耗22.4 L气体时,电路中通过的电子数目为2NA |
| D.标准状况下,0.1mol Cl2溶于水,转移电子数为0.1NA |
下列说法正确的是()
| A.114号元素在周期表中第七周期第VIA族,属于金属元素 |
| B.晶体硅熔点高硬度大,可用于制作光导纤维 |
| C.为了除去MgCl2酸性溶液中的Fe3+而得到较纯净的MgCl2溶液,可在加热搅拌的条件下加入MgCO3,过滤后,再向滤液中加入适量的盐酸 |
| D.光束通过下列分散系①有尘埃的空气②明矾溶液③墨水④稀豆浆时,都能产生丁达尔效应 |