有一种蓝色晶体,它的结构特征是Fe2+和Fe3+分别占据立方体互不相邻的顶点,而CN— 离子位于立方体的棱上。
(1)根据晶体结构特点,推出其化学式(用最简单整数示)______________ __。
(2)此粒子带何种电荷?用什么样的离子可与其结合成电中性的物质?写出此电中性物质的化学式(用M+表示)。
(3)指出(2)中添加离子在晶体结构中的什么位置?
硝酸工业在国民经济、国防工业和航天事业中占有重要地位。随着化学纤维、近代有机合成、火箭、导弹等工业的迅速发展,需要使用大量的硝酸。
(1)工业生产中用铂系金属作为催化剂,用氨氧化法制取硝酸。写出用铂铑合金作催化剂由氨氧化制备硝酸的第一步反应的化学方程式 ▲。浓硝酸和浓硫酸的混合酸是有机合成中常用的硝化剂,写出将苯滴入浓硝酸和浓硫酸混合液中,并在50℃--60℃反应的化学方程式 ▲。
(2)铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)。则硝酸在该反应中的作用是 ▲。如果得到的NO和NO2物质的量相同,写出并配平该反应的离子方程式 ▲,0.6mol Cu被硝酸完全溶解后,若用排水法收集这些气体,可得标准状况下的气体体积为 ▲。
下表为元素周期表的一部分,元素①-⑦是短周期的主族元素,请参照元素①-⑥在表中的位置,回答下列问题:
| ① |
② |
|||||
| ③ |
④ |
⑤ |
⑥ |
⑦ |
(1)写出⑥在元素周期表中的位置 ▲。
(2)②的气态氢化物的沸点 ▲⑥的气态氢化物的沸点。(填大于、小于或等于)
(3)④的最高价氧化物与③的最高价氧化物对应的水化物的水溶液反应的离子方程式为
▲。
(4)①和⑤形成的化合物是化工行业已合成的一种硬度很大、熔点很高的晶体,若已知在此化合物中各元素均处于其最高或最低价态,据此推断:该化合物的化学式可能是 ▲, 与该化合物晶体类型相同的是___▲___(请用相应的编号填写)。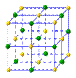
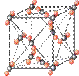
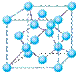
A B C
(5)由①和③形成的化合物甲和乙,甲受到撞击会分解生成一种固体单质和一种气体单质,此反应中反应物、固体单质和气体单质的物质的量之比是2:2:3;乙中加入过量的盐酸后生成两种盐,在其中一种盐中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体。则化合物甲的化学式为 ▲,化合物乙与过量盐酸反应的化学方程式为 ▲。
I:能源是人类生活和社会发展的基础,地球上最基本的能源是 ▲,大自然利用这一能源最成功的是 ▲。氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ·g-1(热值指的是在一定条件下单位质量的物质完全燃烧所放出的热量,氢气转化为液态水。)请写出氢气燃烧的热化学方程式 ▲。
Ⅱ:理论上任意一个自发的氧化还原反应都能设计成原电池,现有如下反应:
2FeCl3 + Cu = 2FeCl2 + CuCl2
如果将其设计成原电池,请写出负极材料及正极电极反应式。
负极材料: ▲;正极电极反应式: ▲。
III:工业上用电解熔融氧化铝的方法制取金属铝。
(1)请写出工业用电解熔融氧化铝制取铝的化学方程式: ▲。
(2)现冶炼2.7 t 铝,需要转移电子的物质的量为 ▲mol。
(8分) 现有分子式均为C3H6O2的四种有机物A、B、C、D,且分子中均含甲基,把它们分别进行下列实验以鉴别之,其实验记录如下:
| NaOH溶液 |
银氨溶液 |
新制Cu(OH)2 |
金属钠 |
|
| A |
中和反应 |
—— |
溶解 |
产生氢气 |
| B |
—— |
有银镜 |
加热后有红色沉淀 |
产生氢气 |
| C |
水解反应 |
有银镜 |
加热后有红色沉淀 |
—— |
| D |
水解反应 |
—— |
—— |
—— |
则A、B、C、D的结构简式分别为:
A,B,C,D。
(1)2,5-二甲基-2,4己二烯的结构简式为:
|
