用0.1 mol/L的Na2SO3溶液30 mL,恰好将2×10-3 mol XO4-还原,则元素X在还原产物中的化合价是( )
| A.+4 | B.+3 | C.+2 | D.+1 |
某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+.为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).由此可以得出关于原溶液组成的正确结论是
| A.一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+ |
| B.一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+ |
| C.c(CO32-)="0.01" mol/L,c(NH4+)>c(SO42-) |
| D.如果上述6种离子都存在,则c(Cl-)>c(SO42-) |
完全沉淀等物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl—,消耗等物质的量浓度的AgNO3溶液的体积比为1:1:1,则上述溶液的体积比为
| A.1:1:1 | B.3:2:1 |
| C.6:3:2 | D.9:3:1 |
某氧化物的化学式为R2O3,电子总数为50,已知氧原子核内有8个中子,R2O3的相对分子质量为102,则R原子核内中子数为
| A.10 | B.12 | C.14 | D.21 |
已知aAm-与bBn+具有相同的核外电子排布,则下列关系正确的是
| A.a=b+m+n | B.a=b-m+n | C.a=b+m-n | D.a=b-m-n |
下图是一种试验某气体化学性质的实验装置,图中B为开关。 如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是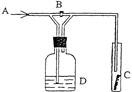
| A.浓H2SO4 | B.饱和Na2CO3溶液 |
| C.浓NaOH溶液 | D.饱和NaCl溶液 |