下列说法正确的是
| A.由H原子形成1molH—H键要吸收热量 |
| B.化学变化中的能量变化的大小与反应物的质量多少无关 |
| C.酸与碱的稀溶液发生中和反应生成1molH2O时所释放的热量称为中和热 |
| D.锌锰干电池中碳棒是负极,锌片是正极 |
下列反应的离子方程式正确的是
| A.向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+H+ |
| B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+= Fe3++3H2O |
| C.向含有0.4 mol FeBr2溶液中通入0.3 mol Cl2充分反应:4Fe2++2Br﹣+3Cl2= 4Fe3++6Cl﹣+Br2 |
D.用Pt电极电解饱和氯化镁溶液:2Cl﹣+2H2O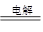 H2↑+Cl2↑+2OH﹣ H2↑+Cl2↑+2OH﹣ |
设NA为阿伏加德罗常数的值,下列叙述中正确的是
| A.常温下,含l mol Fe的铁片与过量浓HNO3反应,转移电子的数目为3 NA个 |
| B.电解饱和食盐水,当阴极产生2.24LH2时,转移的电子数为0.2NA |
| C.标准状况下,33.6 L SO3含有9.03×1023个SO3分子 |
| D.在46 gNO2和N2O4的混合物气体中所含原子总数为3NA个 |
已知:2H2(g)+O2(g) ===2H2O(l)ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g) ===2CO2(g)+4H2O(l)ΔH=-1452 kJ·mol-1
H﹢(aq)+OH﹣(aq) ===H2O(l)ΔH=-57.3 kJ·mol-1
下列说法正确的是
| A.H2(g)的燃烧热为142.9kJ·mol-1 |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
| C.H2SO4(aq)+1/2Ba(OH)2(aq)=1/2 BaSO4(s)+H2O(l)ΔH=-57.3 kJ·mol-1 |
| D.3H2(g)+CO2(g) ===CH3OH(l)+H2O(l)ΔH=+131.4 kJ·mol-1 |
某学生鉴定甲盐的流程如图所示,下列说法正确的是
| A.如果甲中含有S2-,则乙是硫磺沉淀 |
| B.如果乙是AgCl沉淀,那么甲是FeCl3 |
| C.丙中肯定含有Fe3+,所以甲是FeBr2 |
| D.甲中含有铁元素,化合价可能显示+2或者+3 |
如图所示的反应均是在高温后引燃后进行,选项中的物质表示A和B,不合理的是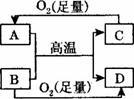
| A.MgO Al | B.CO2 Mg | C.Fe2O3 Al | D.CuO H2 |