将铝片和铜片用导线相连,一组插入浓HNO3溶液中,一组插入稀NaOH溶液中,分别形成了原电池,则在这两个原电池中,正极分别为
| A.铝片、铜片 | B.铜片、铝片 |
| C.铝片、铝片 | D.铜片、铜片 |
部分氧化的Fe—Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:
下列说法正确的是
| A.滤液A中的阳离子为Fe2+、Fe3+、H+ | B.V=224 |
| C.样品中CuO的质量为4.0g | D.V=448 |
在T ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,其中含NH4+的物质的量为b mol。下列叙述中正确的是
A.溶质的质量分数为w=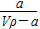 ×100% ×100% |
| B.溶质的物质的量浓度c=1000a/17a mol·L-1 |
| C.溶液中c(OH-)=1000b/V mol·L-1 |
| D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w |
T1℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g) CO2(g)+H2(g),反应过程中测定的部分数据如下表:
CO2(g)+H2(g),反应过程中测定的部分数据如下表:
| 反应时间/min |
n(CO)/mol |
n(H2O)/mol |
| 0 |
1.20 |
0.60 |
| 10 |
0.80 |
|
| 20 |
0.20 |
下列说法正确的是
A.反应在10min内的平均速率为v(H2)=0.04mol · L-1 · min-1
B.保持其他条件不变,起始时向容器中充入0.60 molCO和1.20 mol H2O,达到平衡时n(CO2)= 0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.温度升高至T2℃(T2>T1)时,上述反应平衡常数为0.64,则正反应为吸热反应
氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧;也能与酸反应。用CuSO4溶液和“某物质”在40~50 ℃时反应可产生它。下列有关叙述中错误的是
| A.“某物质”具有还原性 |
| B.CuH与盐酸反应,可能产生H2 |
| C.CuH在氯气中燃烧:CuH+Cl2===CuCl+HCl |
| D.CuH与足量的稀硝酸反应:CuH+3H++NO3—===Cu2++NO↑+2H2O |
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X 与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g· L -1,W在短周期主族元素中原子半径最大。下列说法正确的是
| A.原子半径:W> Y> X |
| B.元素X与M形成化合物的空间构型可以是正四面体型、直线型或平面型等 |
| C.将X Z2通入W单质与水反应后的溶液中,生成的盐一定只有一种 |
| D.Y元素的含氧酸都属于强酸 |