常温下,经测定某溶液中离子只有Na+、CH3COO-、H+、OH-四种,且离子浓度大小的排列顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。其可能的情形是( )
①该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
②该溶液由0.2 mol·L-1的CH3COOH溶液与0.1 mol·L-1的NaOH溶液等体积混合
③该溶液由0.1 mol·L-1的CH3COOH溶液与等物质的量浓度、等体积的NaOH溶液混合而成
| A.① | B.② | C.①② | D.③ |
关于反应中的先后顺序,下列评价正确的是 ( )
| A.向浓度都为0.1 mol/L 的FeCl3和CuCl2混合溶液加入铁粉,CuCl2首先反应 |
| B.向NH4Al(SO4)2溶液中滴加少量的NaOH溶液,NH4+首先反应 |
| C.向浓度都为0.1 mol/LNa2 CO3和NaOH溶液通入CO2气体,NaOH首先反应 |
| D.向浓度都为0.1 mol/L 的FeCl3加入质量相同、颗粒大小相同的铁和铜,铜先反应 |
将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如下图,则下列说法正确的是()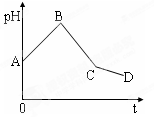
| A.阳极产物一定是Cl2,阴极产物一定是Cu |
| B.BC段表示在阴极上是H+放电产生了H2 |
| C.整个过程中阳极先产生Cl2,后产生O2 |
| D.CD段表示阳极上OH一放电破坏了水的电离平衡,产生了H+ |
研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水” 电池在海水中放电时的有关说法正确的是( )
| A.正极反应式:Ag+Cl--e-=AgCl |
| B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Na+不断向“水”电池的负极移动 |
| D.AgCl是还原产物 |
“分类”的思想方法,在化学发展中起到了重要作用。下列分类标准合理的是()
| A.只含一种元素的物质一定是单质 |
| B.碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 |
| C.溶于水后能电离出H+ 的化合物都为酸 |
| D.有单质生成的反应一定是氧化还原反应 |
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法正确的是( )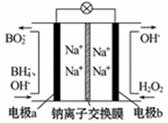
| A.电池放电时Na+从b极区移向a极区 |
| B.电极a采用MnO2,MnO2既作电极材料又有催化作用 |
| C.该电池的负极反应为:BH4-+8OH--8e-=BO2-+6H2O |
| D.每消耗1mol H2O2,转移的电子为1 mol |