下列分子表示的物质一定是纯净物的是 …( )
| A.C5H10 | B.C2H4O2 |
| C.C2H5Cl | D.C2H4Cl2 |
已知4NH3+5O2=4NO+6H2O ,若反应速率分别用V(NH3)、 V(O2)、V(NO)、V(H2O)表示,则正确的关系是
A.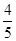 V(NH3)=V(O2) V(NH3)=V(O2) |
B.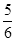 V(O2)=V(H2O) V(O2)=V(H2O) |
C. V(NH3)=V(H2O) V(NH3)=V(H2O) |
D.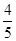 V(O2)=V(NO) V(O2)=V(NO) |
下列说法或表示方法不正确的是
| A.盖斯定律实质上是能量守恒定律的体现 |
| B.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H = –57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ |
| C.由C(石墨)→C(金刚石);△H =" +73" kJ/mol,可知石墨比金刚石稳定 |
| D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H = –285.8kJ/mol |
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为。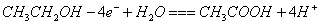
下列有关说法正确的是
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |
C.电池反应的化学方程式为: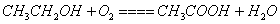 |
D.正极上发生的反应是: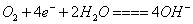 |
下列表述正确的是
| A.0.1mol·L-1Na2CO3溶液中:[OH-]=[HCO3-]+[H+]+[H2CO3] |
| B.0.1mol·L-1CH3COONa溶液中:[Na+]=[CH3COO-]+[OH-] |
| C.CH3COONa、NaOH和Na2CO3三种溶液的pH相同,则浓度大小顺序:c (NaOH) <c (Na2CO3) <c(CH3COONa) |
| D.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至中性,溶液中离子浓度的关系:[CH3COO-]>[Na+]>[OH-]=[H+] |
下列离子方程式中,书写正确的是
A.弱酸酸式盐NaHB在水溶液中水解:HB–+H2O H3O++B2– H3O++B2– |
B.电解饱和食盐水:C1-+2H2O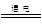 H2↑+Cl2↑+OH- H2↑+Cl2↑+OH- |
| C.氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e-=4OH- |
| D.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |