(10分,每空2分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
还原法在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:
有关离子完全沉淀的pH如下表:
(1)写出Cr2O72—与FeSO4溶液在酸性条件下反应的离子方程式________________________________________________________。
(2)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
则在操作②中可用于调节溶液pH的试剂为:_____________(填序号);
A.Na2O2 B.Ca(OH)2 C.Ba(OH)2 D.NaOH
此时调节溶液的pH范围在____________(填序号)最佳。
A.12~14 B.10~11 C.6~8 D.3~4
(3)将等体积的4.0×10-3mol·L-1的AgNO3和4.0×10-3mol·L-1的K2CrO4溶液混合能析出Ag2CrO4沉淀(Ksp(Ag2CrO4)=9.0×10-12),请写出表示Ag2CrO4溶解平衡的方程式,并简要写出能生成Ag2CrO4沉淀原因的计算过程。
有关短周期元素X、Y、Z、M、N的信息如下:
| 元素 |
有关信息 |
| X |
X元素的原子最外层电子数是电子层数的3倍 |
| Y |
Y元素所在主族序数与所在周期序数之差为4,Y是同周期中原子半径最小的元素 |
| Z |
Z元素的单质在X元素的单质中燃烧,产物是造成酸雨的罪魁祸首之一 |
| M |
M元素的最高价氧化物对应的水化物能与M元素的最简单气态氢化物反应生成盐R |
| N |
N的化合物在灼烧时焰色呈黄色 |
请回答下列问题:
(1)Z元素在第____周期第族。
(2)Y元素的简单阴离子结构示意图为,Y与Z元素的气态氢化物稳定性顺序为____>(写化学式)。
(3)化合物N2X2与CO2反应的化学方程式为。
(4)盐R中含有的化学键类型有。盐R的水溶液显酸性,用离子方程式表示其盐溶液显酸性的原因为。
(5)电解盐NY水溶液的化学方程式为。
【化学——物修5:有机化学】氧有机物甲可用来制取多种有用的化工产品,合成路线如下: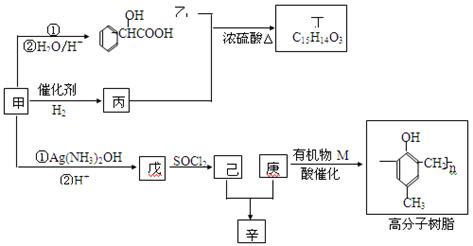
已知: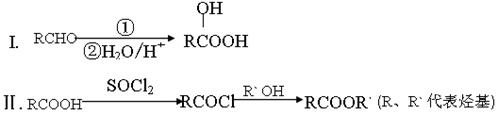
Ⅲ.辛与丁,甲与M分别属于同类物
请回答下列问题:
(1)甲的含氧官能团的名称是;写出检验该官能团常用的一种化学试剂的名称和对应的反应条件。
(2)写出己和丁的结构简式:己,丁。
(3)乙有多种同分异构体,属于甲酸酯,含酚羟基,且酚羟基与酯的结构在苯环邻位的同分异构体共有
种。
(4)在NaOH溶液中发生水解反应时,丁与辛消耗NaOH的物质的量之比为。
(5)庚与M合成高分子树脂的化学方程式为。
【化学——选修3:物质结构与性质】
现有 aA、bB、CC、dD、eE、gG六种短周期非金属元素,a+b=c,a+c=d,a+d=e,d+e=g,C、E、G的单质圴有在中学常见的两种或多种同素异形体。请回答下列问题:
I.(1)G基态原子的核外电子排布式为。
(2)C、D、E元素的第一电离能由大到了小的关系是。(用元素符号表示)
(3)请比较C2A4、D2A4、G2A4三种化合物的沸点由高到低的顺序为。
Ⅱ.BG是一种耐磨材料,其结构与金刚石相似,下图为其晶体结构单元。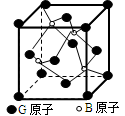
它可由B的三溴化物和G的三溴化物于高温下在氢气的氛围中合成
(1)指出B的三溴化物中B的杂化方式为;G的三溴化物分子的结构为型。
(2)写出合成BG的化学方程式为。
(3)已知晶体中B与G原子的最近距离为apm,则该晶体的密度的表达式为g/cm3。
倡导“低碳经济”。降低大气中CO2的含量,有利于解决气候变暖的环境问题。
(1)工业上可用CO2来生产燃料甲醇。反应原理为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0.
CH3OH(g)+H2O(g) △H<0.
一定温度下,在体积为2L的恒容密闭容器中,充入2molCO2和6molH2.一定条件下发生反应:测得CO2和CH3OH的浓度随时间变化如图所示。
①达到平衡时,CO2的转化率=。
②从反应开始到平衡。氢气的平均反应速率V(H2)=mol/(L·min)。
③容器内的平衡压强与起始压强之比为。
④保持容器容积不变,下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是。
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出来 | D.再充入1molCO2和3molH2 |
⑤某同学依据甲醇燃烧的反应原理,设计如上图所示的电池装置,a、b均为惰性电极。使用时,空气从口通入(填“A”或“B”):a极的电极反应式为。
(2)将一定量的CO2气体通入NaOH溶液中,再向所得溶液中逐滴加入盐酸,边加边振荡至过量,产生的气体与HCl物质的量关系如上图所示(忽略气体的溶解和HCl的挥发)。请回答:O点溶液中溶质的化学式,a点溶液中各离子浓度由大到小的顺序是。
(14分)NaClO具有强氧化性,其溶液可用于游泳池及环境消毒。
(1)已知:
①Cl2(g)+2NaOH(aq)=NaCl(aq)+NaClO(aq)+H2O(l) △H=-101.1kJ·mol-1
②3NaClO(aq)=2NaCl(aq)+NaClO3(aq) △H=-112.2kJ·mol-1
则3Cl2(g)+6NaOH(aq)=5NaCl(aq)+NaClO3(aq)+3H2O(l) △H=
(2)工业上可用石墨电极电解饱和氯化钠溶液制取次氯酸钠溶液装置如图所示
①电源中,a电极名称是
②用此装置电解热的氯化钠溶液时会有部分氯酸钠生成,若电解消耗了117g氯化钠时,电路中共转移的电子为8mol,则次氯酸钠的产率为
(3)向次氯酸钠溶液通入少量的CO2,只生成次氯酸钠和碳酸氢钠,则相同温度下,等物质的量浓度的Na2CO3、NaClO、NaHCO3溶液的pH由大到小的顺序为。
(4)向盛有硫酸酸化的淀粉KI溶液的试管中,滴加少量次氯酸钠溶液,会立即观察到溶液变成蓝色,该反应的离子方程式为。再向上述的蓝色溶液中,继续滴加Na2SO3溶液,又发现蓝色溶液逐渐褪色,该反应的化学方程式为。对比上述两组实验所得结果,比较ClO― 、I2、SO42― 三种微粒氧化性由强到弱的顺序。