将15.6g Na2O2和5.4g Al同时放入一定量的水中充分反应后得到200mL溶液,再向该溶液中缓慢通入HCl气体6.72L(标准状况),若忽略反应过程中溶液的体积变化,则下列判断正确的是
| A.最终得到7.8g的沉淀 | B.反应过程中得到6.72L(标准状况)的气体 |
| C.最终得到的溶液中c(NaCl)=2.0mo/L | D.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) |
下列叙述中,正确的是
| A.14C中含有14个中子 |
| B.1H、2H、3H是同一种核素 |
| C.根据酸溶液中c(H+)大小,可将酸分为强酸和弱酸 |
| D.根据分散质颗粒大小,可将分散系分为浊液、胶体和溶液 |
奥运五环代表着全世界五大洲的人民团结在一起。下列各项中的物质,能满足如图中阴影部分关系的是 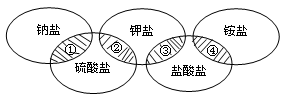
| ① |
② |
③ |
④ |
|
| A |
NaCl |
K2SO4 |
KCl |
(NH4)2SO4 |
| B |
Na2SO4 |
K2SO4 |
KCl |
NH4Cl |
| C |
NaCl |
K2SO4 |
KCl |
NH4Cl |
| D |
Na2SO4 |
K2SO4 |
KCl |
(NH4)2SO4 |
在下列变化中,只发生物理变化的是
| A.空气液化制取氮气 | B.酸雨侵蚀建筑物 |
| C.荔枝酿酒 | D.生石灰遇水成为熟石灰 |
下列实验现象预测正确的是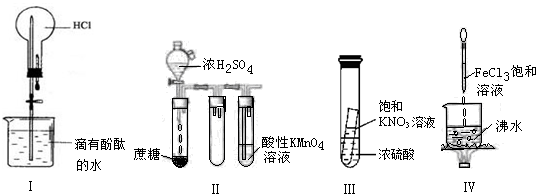
| A.实验I:打开止水夹,烧瓶内出现红色喷泉 |
| B.实验II:酸性KMnO4溶液中出现气泡,颜色无明显变化 |
| C.实验III:静置一段时间,小试管内有晶体析出 |
| D.实验IV:烧杯中液体变为红褐色后,继续加热煮沸,会出现浑浊 |
反应A(g) + B(g) 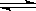 C(g) + D(g) 发生过程中的能量变化如下图,△H 表示反应的焓变。下列说法正确的是
C(g) + D(g) 发生过程中的能量变化如下图,△H 表示反应的焓变。下列说法正确的是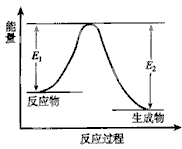
| A.该反应为吸热反应 |
| B.反应体系中加入催化剂,反应速率增大,E1减小,E2增大 |
| C.反应体系中加入催化剂,反应速率增大,△H不变 |
| D.反应达到平衡时,降低温度,A的转化率增大 |