实验室有一瓶新配制的稀盐酸(HCl气体溶于水得到的混合物为稀盐酸),其标签的部分内容如图所示.
(1)计算该稀盐酸中氯元素的质量分数.
(2)某实验小组用这种稀盐酸测定某石灰石样品中碳酸钙的质量分数,实验过程是:称取10g石灰石样品研成粉末,向其中加入7.3%的稀盐酸,产生二氧化碳的质量与加入盐酸的质量关系如图所示.(假设样品中的杂质都不和盐酸反应)计算石灰石样品中碳酸钙的质量分数.
氯化钠是一种重要的化工原料。电解氯化钠溶液可制得氯气、氢氧化钠等物质,反应的化学方程式为2NaCl + 2H2O  Cl2↑+ H2↑+ 2NaOH。现取一定质量的氯化钠溶液进行电解,当氯化钠恰好完全反应时,得到51.2 g溶液,生成氯气的质量与时间的关系如右图所示。
Cl2↑+ H2↑+ 2NaOH。现取一定质量的氯化钠溶液进行电解,当氯化钠恰好完全反应时,得到51.2 g溶液,生成氯气的质量与时间的关系如右图所示。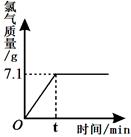
请计算:
(1)氯化钠完全反应时,溶液中剩余水的质量。
(2)原氯化钠溶液中溶质的质量分数。
乙炔(C2H2)是一种重要化工原料,在实验室里可以用碳化钙(CaC2)与水反应制取,该反应的化学方程式为CaC2 + 2H2O = Ca(OH)2 + C2H2↑。若生成52g乙烯气体,同时可以生成多少熟石灰?
过氧乙酸是一种高效广谱杀菌剂。为预防春季传染病的传播,我校拟用0.2%的过氧乙酸溶液对教室、宿舍、公共场所进行环境的表面消毒。市面上常出售每瓶质量为2Kg、质量分数为20%的过氧乙酸溶液,其中含溶质过氧乙酸kg;每瓶可稀释成0.2%的稀溶液kg。
某化学活动小组利用锌和硫酸的反应,来测定某硫酸溶液的溶质质量分数。取30g稀硫酸分三次加入到3.25g锌中,测得有关实验数据如下:
| 加入硫酸溶液的质量 |
剩余锌的质量/g |
参加反应的锌的质量/g |
| ①第一次加入10gH2SO4溶液 |
1.92 |
(此空不要求填写) |
| ②第二次加入10gH2SO4溶液 |
0.59 |
_________ |
| ③第三次加入10gH2SO4溶液 |
0 |
_________ |
(1)请将各次实验中,参加反应的锌的质量填写在表中相应的空格处。
(2)第③次实验中产生了多少克氢克?
(3)所用硫酸溶液的溶质质量分数是多少?
某大型洗衣店的废水经沉淀后直接排放到河流中,使入河口水中的藻类等浮游生物大量繁殖,水呈绿色。
(1)造成这种现象的原因可能是洗衣店排放的废水中含较多的__________元素;
(2)资料显示河水中的藻类的化学式为C xH yO110N16 P 。则该藻类中氮、氧元素的质量比
为___________;
(3)已知该藻类相对分子质量为3550,碳元素的质量分数为35.8%。则式中x的近似值等于___________。