元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是
| A.元素原子的最外层电子数等于元素的最高化合价 |
| B.多电子原子中,在离核较近的区域内运动的电子能量较高 |
| C.P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强 |
| D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
现有以下几种措施:①对燃烧煤时产生的尾气进行除硫处理,②少用原煤作燃料,③燃煤时鼓入足量空气,④开发清洁能源。其中能减少酸雨产生的措施的是()
| A.①②③ | B.②③④ | C.①②④ | D.①③④ |
汽车排放出的尾气中含有NO2,是城市大气主要污染物之一,在日光照射下,NO2发生一系列光化学烟雾的循环反应,从而不断产生O3,加重空气污染。反应过程为:
①NO2 NO+O②2NO+O2====2NO2③O+O2====O3
NO+O②2NO+O2====2NO2③O+O2====O3
下列对该反应过程及有关叙述正确的是()
| A.NO2起催化剂作用 |
| B.NO起催化剂作用 |
| C.NO2只起氧化剂作用 |
| D.O3与O2为同一物质 |
以NA表示阿伏加德罗常数,下列说法正确的是()
| A.NA个N2分子和NA个CO分子质量比为1∶1 |
| B.水的摩尔质量等于NA个水分子的质量之和 |
| C.1 mol氧气的质量等于NA个氧原子的质量 |
| D.分别由NA个水分子组成的冰、水、水蒸气的质量各不相同 |
浓硝酸和浓硫酸是实验室常用的试剂,下列关于浓硝酸和浓硫酸的叙述正确的是()
| A.分别向其中滴加紫色的石蕊试液,现象都是先变红后褪色 |
| B.常温下都能与铜剧烈反应 |
| C.露置在空气中,容器中酸液的质量都增加 |
| D.露置在空气中,容器中酸液的浓度都降低 |
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图1装置),下列有关说法正确的是()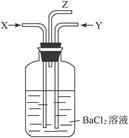
图1
| A.洗气瓶中产生的沉淀是碳酸钡 |
| B.在Z导管出来的气体中无二氧化碳 |
| C.洗气瓶中产生的沉淀是硫酸钡 |
| D.在Z导管口有红棕色气体出现 |