有BaCl2和KCl的混合溶液V L,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗m m ol H2SO4、n mol AgNO3。据此得知原混合溶液中的K+的物质的量浓度为( )
A.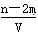 mol·L-1 mol·L-1 |
B. mol·L-1 mol·L-1 |
C. mol·L-1 mol·L-1 |
D.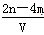 mol·L-1 mol·L-1 |
下列说法正确的是
| A.实验I:充分振荡后静置,上层溶液颜色保持不变 |
| B.实验Ⅱ:酸性KMnO4溶液中出现气泡,但溶液颜色不变 |
| C.实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
| D.实验Ⅳ:煮沸至溶液呈红褐色,停止加热,当光束通过体系时可产生丁达尔效应 |
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。其中Z所处的周期序数与族序数相等。下列说法不正确的是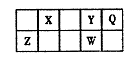
| A.形成简单离子的半径大小顺序:r(W)>r(Z)>r(Y) |
| B.最简单气态氢化物的热稳定性:Y>X |
| C.Q的氢化物的水溶液可用于蚀刻玻璃 |
| D.X、Z的最高价氧化物均可与NaOH溶液反应 |
下列说法正确的是
| A.18gD2O中含有的中子数为10 NA(设NA为阿伏加德罗常数的数值) |
| B.电解精炼铜时,每转移1 mol电子,阳极溶解铜的质量为32 g |
C.恒温恒容下,某可逆反应X(g)+Y(g)  Z(g)+W(s)△H>0达平衡后再加入X,该反应的△H增大 Z(g)+W(s)△H>0达平衡后再加入X,该反应的△H增大 |
| D.右图表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |

下列反应的离子方程式书写正确的是
| A.氯化铝溶液中加入过量氨水:Al3++4 NH3·H2O==AlO2-+4NH4+ +2H2O |
| B.澄清石灰水与足量小苏打溶液混合: Ca2+ +2OH- +2 HCO3-==CaCO3+CO32-+2 H2O |
| C.食醋腐蚀大理石面板:CaCO3 +2 H+= Ca2+ +CO2 +H2O |
| D.少量钠投入硫酸铜溶液中:2Na +Cu2+="2" Na+ +Cu |
下列实验过程中,始终无明显现象的是
| A.O2通入酸化的KI淀粉溶液中 |
| B.CO2通入CaCl2溶液中 |
| C.0.1 mol.L-l稀H2SO4滴入0.1 mol.L-1 Na2S2O3溶液中 |
| D.0.2mol.L-1 H2C2O4溶液滴入酸化的KMnO4溶液中 |