下列溶液中因发生氧化还原反应而不能大量共存的是( )
| A.K+ , Cu2+ , Cl- , SO4 2- | B.Fe3+ , Mg2+ , SCN- , SO42- |
| C.Fe3+ , I- , Ca2+ , Cl- | D.K+ , Ca2+ , CO32- , Cl- |
海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是
| A.利用潮汐发电是将化学能转化为电能 |
| B.海水蒸发制海盐的过程中只发生了化学变化 |
| C.从海水中可以得到NaCl,电解熔融NaCl可制备Na |
| D.海水中含有溴元素,只需经过物理变化就可以得到溴单质 |
实验室由海水获得淡水的实验装置是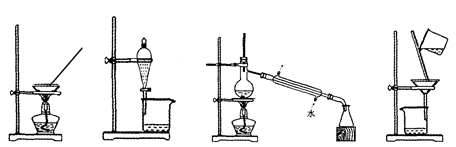
A.B.C.D.
下列反应的离子方程式书写正确的是
| A.锌粒与稀盐酸反应:Zn + 2H+ = Zn2+ + H2↑ |
| B.溴化钠溶液与氯气反应:Br— + Cl2 = Cl— + Br2 |
| C.氢氧化铜与稀硫酸反应:OH—+ H+=H2O |
| D.钠与水反应:Na +2H2O = Na++ 2OH—+ H2↑ |
对下列物质性质或用途的描述不符合事实的是
| A.氯水用于漂白表现了HClO的强氧化性 |
| B.将一小块金属钠投入稀硫酸铜溶液中会有红色固体析出 |
| C.过氧化钠可用作呼吸面具中的供氧剂 |
| D.等质量的Na2CO3和NaHCO3两种固体,分别与过量盐酸反应,NaHCO3生成CO2的质量比较多 |
用NA表示阿伏加德罗常数的数值,下列说法正确的是
| A.1 mol Cl2与足量的铁反应转移的电子数是2 NA |
| B.常温常压下22.4 L HCl气体含有的分子数是NA |
| C.0.1 mol/L CuCl2溶液中Cl-数目是0.2 NA |
| D.32 g O2中含有的原子数是 NA |