已知A~O各代表一种物质,除O外其余物质均由短周期元素组成,它们之间的转化关系如下图所示(反应条件略)。A、B、H分别是单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比 为2︰3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉 淀。
请回答下列问题:(1)组成B单质的元素位于周期表第 周期,第 族。化合物C和D的电子式为 ___ 、_____________。
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是 。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:
(4)写出D与足量的N反应生成E和F的化学方程式: 。
写出G与F加热反应生成K、I和J的化学方程式: 。
(5)上图中在同一反应里一种物质作氧化剂,又作还原剂,这样的反应共有 个。
已知:
①在稀碱溶液中,溴苯难发生水解
②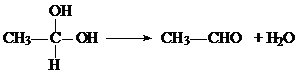
现有分子式为C10H10O2Br2的芳香族化合物X,其苯环上的一溴代物只有一种,其核磁共振氢谱图中有四个吸收峰,吸收峰的面积比为1:2:6:1,在一定条件下可发生下述一系列反应,其中C能发生银镜反应,E遇FeCl3溶液显色且能与浓溴水反应。
请回答下列问题:
(1)X中官能的名称是______________。
(2)F→H的反应类型是_________________。
(3)I的结构简式为___________________;
(4)E不具有的化学性质________(选填序号)
a.取代反应b.消去反应
c.氧化反应 d.1molE最多能与2molNaHCO3反应
(5)写出下列反应的化学方程式:
①X与足量稀NaOH溶液共热的化学方程式:________________ ;
②F→G的化学方程式:____________________;
(6)同时符合下列条件的E的同分异构体共有_____ 种,其中一种的结构简式为________。
a.苯环上核磁共振氢谱有两种
b.不能发生水解反应
c.遇FeCl3溶液不显色
d.1molE最多能分别与1molNaOH和2molNa反应
某研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明):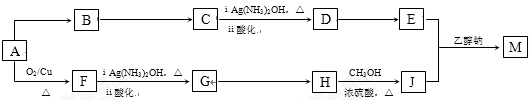
已知:① E的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同环境的氢原子,其个数比为3︰1。
②
(R、R′、R″代表相同或不相同的烃基)
(1)A分子中的含氧官能团的名称是 。
(2)D→E反应的化学方程式是 。
(3)A→B反应所需的试剂是 。
(4)G→H反应的化学方程式是 。
(5)已知1 mol E 与2 mol J 反应生成1 mol M,则M的结构简式是 。
(6)E的同分异构体有下列性质:①能与NaHCO3反应生成CO2;②能发生水解反应,且水解产物之一能发生银镜反应,则该同分异构体共有 种,其中任意1种的结构简式是 。
(7)J 可合成高分子化合物,该高分子化合物结构简式是 。
化合物A~H的转化关系如下图所示,A是一种军用催泪弹的主要成分。已知:
i:A的相对分子质量为161,除含有C、H元素外,它还含有一种卤族元素,分子中只含有一个甲基。
ⅱ.足量的新制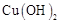 悬浊液与1 mol C反应可生成1 mol
悬浊液与1 mol C反应可生成1 mol 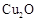 和1
和1 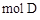 。
。
ⅲ.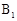 和
和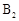 互为同分异构体,
互为同分异构体,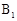 的摩尔质量为
的摩尔质量为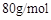 。
。
ⅳ. 和
和 互为同分异构体,二者的核磁磁共振氢谱均只有两种氢环境,
互为同分异构体,二者的核磁磁共振氢谱均只有两种氢环境, 无甲基。
无甲基。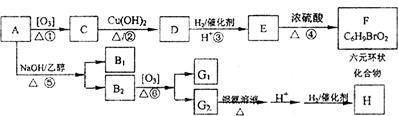
已知:①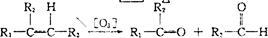
②一个碳原子上连有两个碳碳双键的结构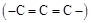 不稳定。
不稳定。
请完成下列问题:
(1)A中官能团的名称 。
(2)①~⑥反应中属于消去反应的是 ;A的结构简式 。
(3)反应④的化学方程式 。
(4)C与新制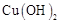 反应的方程式 。
反应的方程式 。
(5)一定条件下H能够生成高分子化合物,此反应的化学方程式 。
(6)与E具有相同官能团且含有三个甲基的同分异构体共有 种;写出其中一个的结构简式为 。
I 含碳原子数最少且存在同分异构体的烷烃的分子式是_____,其同分异构体的结构简式是________。
II从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)A的电子式_______,B的结构简式_______。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:___________,反应类型:_______。
(3)在碘水中加入B振荡静置后的现象________________。
(4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:_____________,反应类型:________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量________(填A>B、A<B或A=B”)。
III已知乙烯能发生以下转化:
(1)C中含官能团名称_________;
(2)写出反应的化学方程式及反应类型:
B与D反应的化学方程式__________________;反应类型:________。
(2小题每空3分,1、3小题每空2分,共16分)已知两个醛分子在NaOH溶液作用下可以发生加成反应,生成一种羟基醛:
肉桂醛F(分子式为C9H8O)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的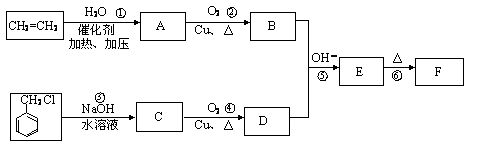
已知:反应⑥为含羟基的物质在浓硫酸催化作用下分子内脱水的反应。反应⑤为碱性条件下醛醛加成反应,请回答
(1)肉桂醛F的结构简式为: 。E中含氧官能团的名称为 。
(2)写出下列转化的化学方程式:
②_____________________。
③ 。
写出有关反应的类型:① ,④ 。
(3)符合下列要求的E物质的同分异构体有 种(苯环上有两个取代基,其中有一个甲基在对位且属于酯类)。