某种元素的电离能数据如下(单位:kJ/mol),该元素最可能是
| Ⅰ1 |
Ⅰ2 |
Ⅰ3 |
Ⅰ4 |
| 740 |
1500 |
7700 |
10500 |
A.S区元素 B.f区元素 C.p区元素 D.d区元素
可逆反应2NO2(g)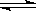 N2O4(g) △H<0,在密闭容器中进行并达到平衡,欲通过改变条件达到新平衡后使混合气体颜色加深,可采取的措施是
N2O4(g) △H<0,在密闭容器中进行并达到平衡,欲通过改变条件达到新平衡后使混合气体颜色加深,可采取的措施是
| A.增大容器体积 |
| B.保持温度压强不变,充入N2O4(g) |
| C.保持温度压强不变,充入NO2(g) |
| D.保持容器容积不变,升高温度 |
某学生的实验报告所列出的下列数据中合理的是
| A.用25mL滴定管做中和滴定实验时,用去某浓度的碱溶液21.70mL |
| B.用托盘天平称得25.20g NaCl |
| C.用广泛pH试纸测得某溶液的pH为2.3 |
| D.用10mL量筒量取7.13mL稀盐酸 |
下列说法或表示方法正确的是
| A.等质量的硫蒸气和硫固体分别在氧气中完全燃烧,后者放出的热量多 |
| B.由C(石墨)=C(金刚石) ΔH=+1.9 kJ/mol,可知金刚石比石墨稳定 |
| C.水力(水能)按不同的分类可看成可再生能源和一级能源 |
| D.可表示氢气燃烧热的热化学方程式为H2(g)+1/2O2(g)=H2O(g)ΔH=-241.8 kJ/mol |
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知有关原溶液中离子的说法不正确是()
| A.SO42-、NH4+一定存在 |
| B.CO32-、Al3+、K+一定不存在 |
| C.Cl-一定存在,且c(Cl-)≥0.4mol/L |
| D.至少存在4种离子 |
下图为海水综合利用的工业流程图,判断下列说法正确的是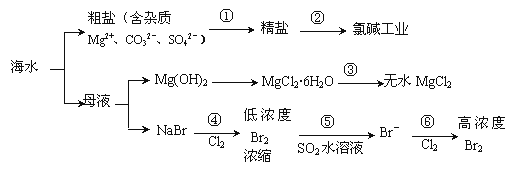
| A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 |
| B.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2 |
| C.在过程④、⑥反应中每氧化0.2 mol Br-需消耗0.1mol Cl2 |
| D.除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |