非金属元素A与金属元素B的离子具有相同电子层结构,原子半径B>A,它们可形成离子化合物B2A,由此下列正确判断是
| A.A可能在第3周期ⅥA族 | B.B+离子半径大于A2–离子半径 |
| C.A的电负性大于B的电负性 | D.A的第一电离能小于B的第一电离能 |
甲、乙两容器中都在进行A B +C的反应,甲中每分钟减少4 molA,乙中每分钟减少2 molA,则甲、乙两容器中的反应速率的比较是
B +C的反应,甲中每分钟减少4 molA,乙中每分钟减少2 molA,则甲、乙两容器中的反应速率的比较是
| A.甲更快 | B.无法确定 | C.相等 | D.乙更快 |
反应①1000K时,A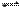 B +C;②500K时,D
B +C;②500K时,D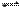 E +F,它们的反应速率的关系是
E +F,它们的反应速率的关系是
| A.①=② | B.①﹤② | C.①﹥② | D.无法确定 |
设C+CO2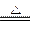 2CO,正反应是吸热反应,反应速率为v1;N2+3H2
2CO,正反应是吸热反应,反应速率为v1;N2+3H2 2NH3正反应为放热反应,反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为
2NH3正反应为放热反应,反应速率为v2。对于上述反应,当温度升高时,v1和v2的变化情况为
| A.同时增大 | B.同时减小 | C.v1增大,v2减小 | D.v1减小,v2增大 |
一定条件下,在2L的密闭容器中充入2 molSO2和一定量的O2,发生反应2SO2(g)+O2(g)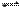 2SO3(g),进行到4min时,测得n (SO2) = 0.4mol,若反应进行到前2min末时,容器中n (SO2)为
2SO3(g),进行到4min时,测得n (SO2) = 0.4mol,若反应进行到前2min末时,容器中n (SO2)为
| A.1.6 mol | B.1.2 mol | C.大于1.6 mol | D.小于1.2 mol |
某温度下,浓度都是1 mol/L的两种气体X2和Y2,在密闭容器中反应生成Z,反应2min后,测得参加反应的X2为0.6mol/L,用Y2变化表示的反应速率v(Y2)= 0.1mol/(L?min),生成的c(Z)="0.4" mol/L,则该反应方程式为
A.X2+2 Y2 2XY2 2XY2 |
B.2X2+Y2 2X2Y 2X2Y |
C.3X2+Y2 2X3Y 2X3Y |
D.X2+3Y2 2XY3 2XY3 |