已知:3Cl2+6KOH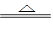 5KCl+KClO3+3H2O,发生氧化反应和还原反应的物质其物质的量之比为 ( )
5KCl+KClO3+3H2O,发生氧化反应和还原反应的物质其物质的量之比为 ( )
| A.1:2 | B.3:1 | C.5:1 | D.1:5 |
将下图所示实验装置的K闭合,下列判断正确的是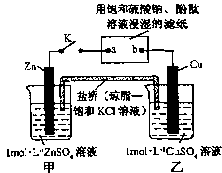
| A.盐桥中的Cl-向乙烧杯方向移动 | B.盐桥中有电子通过 |
| C.乙中的铜棒逐渐变细 | D.片刻后可观察到滤纸a点变红色 |
设NA为阿伏伽德罗常数的数值,下列说法正确的是
| A.1.00molNaCl固体中含有6.02×1023个NaCl分子 |
| B.46gNO2和N2O4混合气体中含有原子总数为3NA |
| C.1molFe2+ 与足量的H2O2溶液反应,转移2NA个电子 |
| D.25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.1 mol甲醇中含有C—H键的数目为4NA |
| B.25 ℃,pH=13的NaOH溶液中含有OH-的数目为 0.1NA |
| C.标准状况下,2.24 L己烷含有分子的数目为0.1NA |
| D.常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA |
关于氧化剂的叙述正确的是
| A.分子中不一定含有氧元素 | B.分子中一定含有氧元素 |
| C.在反应中易失电子的物质 | D.是反应生成的物质 |
如图为氢氧燃料电池原理示意图,下列叙述不正确的是
| A.a电极是负极 |
| B.b电极上发生氧化反应 |
| C.该电池工作时化学能转化为电能 |
| D.该电池的总反应为2H2 + O2 =2H2O |