地沟油中含有一种强烈致癌物黄曲霉素B2(C17H14O6),长期食用会引起消化道癌变,请回答:
(1)黄曲霉素B2的相对分子质量为 ;
(2)黄曲霉素B2中碳、氢、氧三种元素的原子个数比为 ;
(3)15.7g黄曲霉素B2中含有多少克氧元素?(写出计算过程)
街头上有许多便宜的“黄金”饰品出售,实际上它们不是黄金,而是铜锌合金,因其具有较好的机械性能和光泽度,所以常被做成饰品.现取30g该合金样品,投入到196g某浓度的稀硫酸中,恰好完全反应后,剩余的溶液和残余固体总质量为225.6g.请计算:
(1)产生氢气的质量为 g
(2)剩余溶液中溶质的质量分数是多少?(结果保留到1%).
在盛有40g溶质质量分数为20%氢氧化钠溶液的烧杯中,用滴管吸取盐酸逐滴加入盛有氢氧化钠溶液的烧杯中,验证“中和反应会放热”,同时用pH计记录溶液pH的变化,绘制成以下函数图像。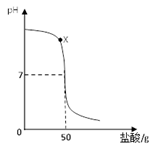
(1)用玻璃棒蘸取X点溶液,在酒精灯火焰上加热至蒸干,玻璃棒上留下的固体中一定含有。(填化学式)
(2)为什么不能用氢氧化钠固体和稀盐酸反应验证“中和反应会放热”。 。
(3)当pH=7时,求溶液中溶质的质量分数。
某学生做了如下图所示的实验。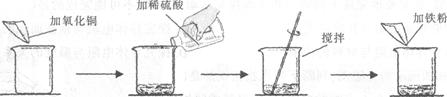
| 第一次 |
第二次 |
|
| 加入氧化铜的质量 |
m |
m |
| 加入稀硫酸的质量 |
50g |
100g |
| 加入铁粉的质量 |
5.6g |
5.6g |
| 实验现象 |
黑色固体和紫红色固体 |
紫红色固体 |
若第二次所加物质恰好完全反应(滤液损失忽略不计),请回答下列问题:
(1)写出实验中发生反应的化学方程式
(2)第一次实验后的固体物质的化学式为
(3)根据已知条件列出求解第二次实验生成固体物质的质量(x)的比例式
(4)实验中加入氧化铜的质量(m)为;
(5)若向第二次反应后的滤液中加入92.8g水,则所得不饱和溶液中溶质的质量分数为;
(6)若用溶质质量分数为49%的硫酸溶液配制实验中所需的稀硫酸,则需要加水的质量
为。
随机抽取市售某种“纯碱”样品,经检验杂质仅是氯化钠。准确称取样品20克,加入100克稀盐酸溶液使其恰好完全反应,将反应后的剩余物质称量,质量为117.8克。
(1)生成二氧化碳质量是克。
(2)所用稀盐酸的质量分数是多少?
为研究某含C、H、O元素的有机物的组成,将8.00g该有机物在氧气中充分燃烧,并将生成物全部通过如图的装置,测得下表的结果。(提示:氯化钙是干燥剂)

求:①该有机物所含各元素的质量;
②该有机物中C元素的质量分数;
③该有机物的化学式(最简式)。