甲、乙、丙、丁、戊为原子序数依次增大的短周期元素。甲、丙处于同一主族,丙、丁、戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和。甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时得到一种白烟Y和一种强酸Z,丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐;丙、戊可组成化合物M。请回答下列问题
(1)戊离子的结构示意图为_______________。
(2)写出Y的电子式: ______。用电子式表示Z的形成过程:____________________
_____________________________________________________________________。
(3)写出丁的最高价氧化物的水化物与丙的最高价氧化物的水化物反应的离子方程式:___________ __________________________________________________________。
(4)戊的单质与X反应生成的Y和Z的物质的量之比为2:4,反应中被氧化的物质与被还原的物质的物质的量之比为________。
考查知识点:由原子结构、元素及其化合物的性质推测性质。离子的结构示意图,电子式的书写,以及用电子式表示共价化合物的形成过程。氧化还原反应中,利用电子守恒的计算。
【化学一选修S有机化学基础t】(15分)己知G是一种高分子塑料, 在酸性条件下水解生成M和N:
在酸性条件下水解生成M和N:
用N制取G的流程如下:
请回答下列问题:
(1)化合物E中所含两种官能团的名称是.
(2)己知F的分子式为 的反应类型是。若F分子中核磁共振氢谱的峰面积之比为1:1:2:2:6写出F的结构简式。
的反应类型是。若F分子中核磁共振氢谱的峰面积之比为1:1:2:2:6写出F的结构简式。
(3)N转化为X的化学方程式为。E转化为G的化学方程式为。
(4)化合物M不能发生的反应是(填字母代号)。
a.加成反应
b.缩聚反应
c.消去反应
d.醋化反应
e.水解反应
f.置换反应
(5)同时符合下列三个条件的M的同分异构体有种(不考虑立体异构)。
I、含有间二取代苯环结构II.属于酯 III.与FeC13溶液发生显色反应。写出其中不含甲基的一种同分异构体的结构简式
【化学一有机化学基础】(13分)
已知:
杨梅酯是制作冰制食品、糖果等的香料,可由如下路线合成
(1)杨梅酯在一定条件下水解生成。 下列有关该物质的叙述中,正确的是________。
下列有关该物质的叙述中,正确的是________。
| A.能与溴的四氯花碳溶液发生加成反应 |
| B.无法使酸性高锰酸钾溶液褪色 |
| C.可能发生消去反应 |
| D.可能发生缩聚反应 |
(2)B中的官能团名称为_____________。
(3)①的化学方程式为____________________________,反应类型为____________________.
(4)D 的结构简式为__________________________________。
(5)写出符合下列条件的杨梅酯的一种同分异构体的结构简式________________________。
①苯环上有1,3,5三个取代基;
②苯环上一氯取代物有两种;
③lmol 该物质与新制Cu(OH)2, 悬浊液反应理论上可生成2lmol Cu2O
选考[有机化学基础]双酚A型环氧树脂是由双酚A、环氧氯丙烷在碱性条件下缩合而成的高分子化合物。具有良好的物理化学性能,被广泛应用于涂料、胶粘剂等领域。根据该树脂的合成路线图示,回答以下问题: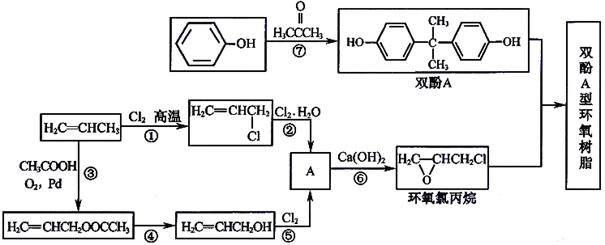
(1)写出上图中②⑥两步的反应方程式:②_________________⑥_________________
(2)乙酸丙烯酯(H2C=CHCH2OOCCH3)有多种同分异构体,其中能发生银镜反应,且核磁共振氢谱上只有两种峰,强度比为3:1的同分异构体的结构简式为__________________;其中既可以和NaHCO3溶液又能与溴水反应的物质有_____种(不考虑立体异构)。
(3)双酚A的另一重要用途是和光气(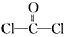 )合成Lexan聚碳酸酯(一种高强材料,可用于制作防弹窗户)。写出此合成反应的化学方程式:_________________________。
)合成Lexan聚碳酸酯(一种高强材料,可用于制作防弹窗户)。写出此合成反应的化学方程式:_________________________。
【化学—选修有机化学基础】(15分)现有分子式为CnH8O2X2的物质M,可发生如下所示转化: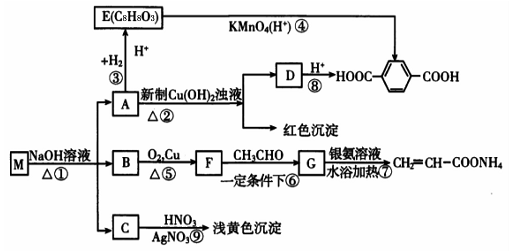
已知:①物质B在质谱分析中,在质谱图显示存在多种质荷比不相同的粒子,其中质荷比最大的为32,物质B在核磁共振氢谱分析中,有两个吸收峰,吸收峰面积之比为3∶1。
②两个—OH同时连在一个C原子上,结构不稳定,会自动失水,如: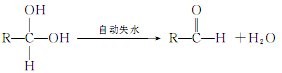
请回答下列问题:
(1)n值为 ,X为 (填元素符号)。
(2)①、③的反应类型:① ,③ 。
(3)写出M、E、G的结构简式;
M: ;
E: ;
G: 。
(4)写出下列反应的化学方程式:
A→D:;
B→F: 。
(5)写出符合下列条件的E的同分异构体的结构简式
①属于酯
②属于酚
③不能发生银镜反应
④苯环上的一溴代物只有两种, 。
(15分)无机化合物A主要用于药物制造。在一定条件下,2.30g固体A与5.35gNH4Cl固体恰好完全反应,生成固体B和4.48L气体C(标准状况)。气体C极易溶于水得到碱性溶液,电解无水B可生成一种短周期元素的金属单质D和氯气。由文献资料知道:工业上物质A可用金属D与液态的C在硝酸铁催化下反应来制备,纯净的A物质为白色固体,但制得的粗品往往是灰色的;物质A的熔点390℃,沸点430℃,密度大于苯或甲苯,遇水反应剧烈,也要避免接触酸、酒精。在空气中A缓慢分解,对其加强热则猛烈分解,在750~800℃分解为化合物E和气体C。
回答下列问题:
(1)A的化学式 。
(2)A与盐酸反应的化学方程式为 。
(3)A在750~800℃分解的方程式为,制得的粗品往往是灰色的,其可能的原因是。
(4)久置的A可能大部分变质而不能使用,需要将其销毁。遇到这种情况,可用苯或甲苯将其覆盖,然后缓慢加入用苯或甲苯稀释过的无水乙醇,试解释其化学原理: 。
(5)工业制备单质D的流程图如下:
①步骤①中操作名称是 。
②试用平衡移动原理解释步骤②中减压的目的是 。
(6)写出D的重氢化合物与水反应的化学方程式为 。