有机物甲可氧化生成羧酸,也可还原生成醇。由甲生成的羧酸和醇在一定条件下,可以生成化合物乙,其分子式为C2H4O2。下列叙述中不正确的是( )
| A.甲分子中C的质量分数为40% |
| B.甲在常温常压下为无色液体 |
| C.乙比甲的沸点高 |
| D.乙和甲的最简式相同 |
已知A、B、C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按如图进行反应。下列说法中不正确的是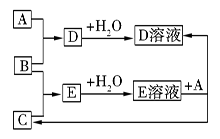
A.A、B、C中三种元素的任意两种元素形成的化合物所属物质类别可能是氧化物
B.A、B、C中三种元素形成的化合物所属物质类别一定不是碱
C.如果E溶液是一种强酸,则E溶液为盐酸
D.A、B、C中有一种金属且为A
向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是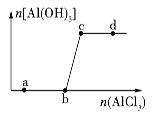
| A.a点对应的溶液中:Na+、Mg2+、SO42-、HCO3- |
| B.b点对应的溶液中:Ag+、Ca2+、NO3-、F- |
| C.c点对应的溶液中:Na+、S2-、SO42-、Cl- |
| D.d点对应的溶液中:K+、NH4+、I-、CO32- |
为提纯下列物质(括号内为杂质)选用的试剂和分离方法都正确的是
| 物质 |
试剂 |
分离方法 |
|
| ① |
硝酸钾(氯化钠) |
蒸馏水 |
结晶 |
| ② |
二氧化碳(氯化氢) |
饱和碳酸钠溶液 |
洗气 |
| ③ |
乙醇(水) |
金属钠 |
蒸馏 |
| ④ |
NaCl溶液(Na2S) |
AgCl |
过滤 |
A.①③B.①④C.②D.③④
利用下列各组物质制备和收集少量相应气体,能采用下图实验装置的是
| A.FeS与稀硫酸 | B.铜与浓硫酸 |
| C.稀硝酸与铜片 | D.电石与水 |
双羟基铝碳酸钠是医疗上常用的一种抑酸剂,化学式是NaAl(OH)2CO3关于该物质的说法正确的是
| A.该物质是Al(OH)3和Na2CO3的混合物 |
| B.该物质属于复盐 |
| C.该药剂适合胃溃疡患者服用 |
| D.1 mol NaAl(OH)2CO3最多可消耗4 mol H+ |