某校化学研究性小组,利用下列提供的实验装置和试剂对某种燃煤所
含元素进行定性和定量检测,试回答: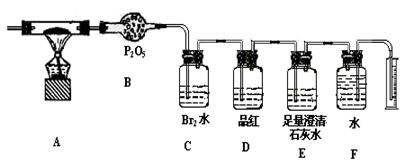
(1)将燃煤充分燃烧,产生气体经化学分析主要含有CO2、H2O、SO2、N2四种气体,则该燃煤一定含有的元素为 .
(2)称取该燃煤样品Wg,通入纯氧使其充分燃烧,检测该燃煤中所含上述元素的质量分数。利用下列装置进行实验:
①指出上述装置中B、C、D、E的作用
B C
D E
②为了准确测量F中收集到的气体体积并能根据实验时温度、压强计算其物质的量,正确的实验操作是
溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
完成下列填空:
(1)上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸的HBr 500ml,所需的玻璃仪器有玻璃棒、烧杯、量筒、、 。
(2)已知步骤Ⅲ的滤液中不含NH4+。步骤Ⅱ加入的试剂a是 ,控制溶液的pH约为8.0的目的是。步骤Ⅳ的目的是 。
(3)制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤、洗涤、干燥、称量。若得到1.88g碳酸钙,则溴化钙的质量分数为 (保留两位小数)。
②若实验操作规范而测定结果偏低,其原因是。
3-丁酮酸乙酯在有机合成中用途极广,广泛用于药物合成,还用作食品的着香剂。其相对分子质量为130,常温下为无色液体,沸点181℃,受热温度超过95℃摄氏度时就会分解;易溶于水,与乙醇、乙酸乙酯等有机试剂以任意比混溶;实验室可用以乙酸乙酯和金属钠为原料制备。乙酸乙酯相对分子质量为88,常温下为无色易挥发液体,微溶于水,沸点77℃。
【反应原理】
【实验装置】
【实验步骤】
1.加热反应:向反应装置中加入32 mL(28.5g,0.32mol)乙酸乙酯、少量无水乙醇、1.6 g(0.07mol)切细的金属钠,微热回流1.5~3小时,直至金属钠消失。
2.产物后处理:冷却至室温,卸下冷凝管,将烧瓶浸在冷水浴中,在摇动下缓慢的加入32 mL 30%醋酸水溶液,使反应液分层。用分液漏斗分离出酯层。酯层用5%碳酸钠溶液洗涤,有机层放入干燥的锥形瓶中,加入无水碳酸钾至液体澄清。
3.蒸出未反应的乙酸乙酯:将反应液在常压下蒸馏至100℃。然后改用减压蒸馏,得到产品2.0g。
回答下列问题:
(1)从反应原理看,无水乙醇的作用是。
(2)反应装置中加干燥管是为了。两个装置中冷凝管的作用(填“相同”或“不相同”),冷却水进水口分别为和(填图中的字母)。
(3)产物后处理中,滴加稀醋酸的目的是,稀醋酸不能加多了,原因是。用分液漏斗分离出酯层的操作叫。碳酸钠溶液洗涤的目的是。加碳酸钾的目的是。
(4)采用减压蒸馏的原因是。
(5)本实验所得到的3-丁酮酸乙酯产率是(填正确答案标号)。
| A.10% | B.22% | C.19% | D.40% |
三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体。实验室合成三苯甲醇的实验装置如图所示。
已知:①过程中生成的中间物质格氏试剂易发生水解反应;
②部分相关物质的沸点如下:
| 物质 |
沸点/℃ |
| 三苯甲醇 |
380 |
| 乙醚 |
34.6 |
| 溴苯 |
156.2 |
③三苯甲醇的相对分子质量为260。
请回答下列问题:
(1)装置中玻璃仪器B的名称为;装有无水CaCl2的仪器A的作用是。
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是;制取格氏试剂时要保持温度约为40℃,可以采用加热方式。
(3)制得的三苯甲醇粗产品中含有乙醚、溴苯、氯化铵等杂质,可以设计如下提纯方案:
其中,操作①的名称是;洗涤液最好选用(填字母序号)。
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为。
(4)纯度测定:称取2.60 g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80 mL。则产品中三苯甲醇的质量分数为。
(16分)某研究小组想探究炭与浓硝酸的反应。其实验过程如下。
| 操作 |
现象 |
| a.用干燥洁净的烧杯取约10mL浓硝酸,加热。 |
|
| b.把小块烧红的木炭迅速放入热的浓硝酸中。 |
红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮,上下反复跳动。 |
(1)热的浓硝酸与红热的木炭接触会发生多个化学反应。
①炭与浓硝酸的反应,说明浓硝酸具有性。
②反应产生的热量会使少量浓硝酸受热分解,该反应的化学方程式为。
(2)实验现象中液面上木炭迅速燃烧,发出光亮。小组同学为了研究助燃气体是O2还是NO2,设计了以下实验。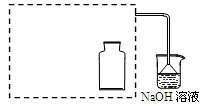
Ⅰ.制取NO2气体。
①在虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图(夹持仪器略)。
②NaOH溶液的作用是吸收多余的NO2,反应生成两种物质的量相等的正盐,写出反应的的离子方程式。
Ⅱ.探究实验。
实验操作:在空气中引燃木炭,使其燃烧并带有火焰,将带火焰的木炭伸入盛有NO2气体的集气瓶中。
实验现象:木炭在NO2气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
①根据实验现象写出碳与NO2气体反应的化学方程式。
②通过实验探究,你认为上表操作b中助燃气体是什么,简述理由。
现有含有少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如下图所示。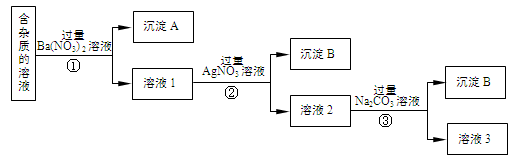
(1)沉淀A的主要成分是(填化学式)。
(2)②中反应的离子方程式是。
(3)①②③中均进行的分离操作是。
(4)溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是,为了除去杂质,可向溶液3中加入适量的。
(5)实验室用上述实验获得的NaNO3固体配制500 mL 0.40 mol/L NaNO3溶液。
①配制溶液时,进行如下操作:a.定容;b.计算;c.溶解;d.摇匀;e.转移;f.洗涤;j.称量。称取NaNO3固体的质量是g。
按照操作顺序,第4步是(填序号)。
②某同学转移溶液的操作如图所示,该同学操作中的错误是。
③若用胶头滴管定容时,不小心滴水滴过了刻度线,你认为应该采取的处理方法是:。
④下列操作中,可能造成所配制溶液的浓度偏低的是(填选项)。
a.没有洗涤烧杯和玻璃棒
b.定容时,俯视刻度线
c.洗涤后的容量瓶中残留少量蒸馏水