根据元素周期表中元素性质变化规律,ⅥA族元素不可能有的性质是( )
| A.从上到下非金属性减弱 | B.从上到下元素原子半径增大 |
| C.从上到下单质熔沸点升高 | D.该族元素都有的化合价为+6、-2 |
X元素的最高价氧化物对应的水化物化学式为H2XO3,则它对应气态氢化物的化学式为
| A.HX | B.H2X | C.XH3 | D.XH4 |
0.02 mol某金属单质与足量的盐酸反应,放出0.672 LH2(标准状况),并转变为具有Ne原子的电子层结构的离子,该金属元素在元素周期表中的位置是()
| A.第三周期第ⅡA族 | B.第三周期第ⅢA族 |
| C.第二周期第ⅢA族 | D.第四周期第ⅡA族 |
某元素原子核外电子排布为:第二层上的电子数比第一层与第三层电子数之和的两倍还多2,该元素是
| A.Na | B.Mg | C.Al | D.Cl |
现代科技将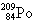 涂于飞机表面,可以吸收和屏蔽雷达波和红外线辐射,从而达到隐形目的。下面列出该原子核内中子数与核外电子数之差的数据正确的是
涂于飞机表面,可以吸收和屏蔽雷达波和红外线辐射,从而达到隐形目的。下面列出该原子核内中子数与核外电子数之差的数据正确的是
A.84B.41C.125 D.209
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3 + N2 + 3C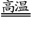 2AlN + 3CO↑
2AlN + 3CO↑
下列叙述不正确的是
| A.在氮化铝的合成反应中,N2是还原剂 |
| B.在氮化铝的合成反应中,C是还原剂 |
| C.氮化铝中氮元素的化合价为-3 |
| D.上述反应中每生成1molAlN,转移3 mol e- |