下列物质的类别与所含官能团都表达错误的是( )
A.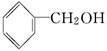 醇类 —OH 醇类 —OH |
| B.CH3CH2CH2COOH羧酸 —COOH |
C.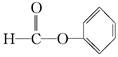 醛类 —CHO 醛类 —CHO |
D.CH3—O—CH3醚类 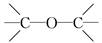 |
下列叙述正确的是
| A.pH=3的酸溶液稀释l00倍后pH=5 |
| B.相同温度下,pH=3的溶液和pH=5的溶液相比,前者氢离子浓度是后者的100倍 |
| C.相同温度相同浓度的钾盐溶液中,酸式盐的pH一定小于正盐的pH |
| D.碳酸钠溶液在室温时的pH一定大于60℃时的pH |
已知25OC时,电离常数Ka(HF)=3.6 10-4 mol
10-4 mol L-1,溶度积常数Ksp(CaF2)=1.46×10-10mol3
L-1,溶度积常数Ksp(CaF2)=1.46×10-10mol3 L-3。现向1L0.2 mol
L-3。现向1L0.2 mol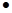 L-1HF溶液中加入1L0.2 mol
L-1HF溶液中加入1L0.2 mol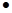 L-1CaCl2溶液,
L-1CaCl2溶液,
则下列说法中,正确的是
A.25oC时,0.1 mol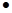 L-1HF溶液中pH=1 L-1HF溶液中pH=1 |
B.Ksp(CaF2)随温度和浓度的变化而变化 |
C.该体系中Ksp(CaF2)= |
D.该体系中有CaF2沉淀产生 |
金属镍有广泛应用。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知氧化性Fe2+<Ni2+<Cu2+)
| A.阳极发生还原反应,其主要电极反应式:Ni2++2e- ="===" Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ |
| D.电解后,电解槽底部的阳极泥中含有Cu和Pt |
根据下列事实:(1)X+Y2+===X2++Y;(2)Z+2H2O====Z(OH)2+H2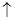 (3)Z2+氧化性比X2+弱;(4)由Y、W电极组成的原电池,电极反应为:W2++2e-===W,Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序是
(3)Z2+氧化性比X2+弱;(4)由Y、W电极组成的原电池,电极反应为:W2++2e-===W,Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序是
| A.X>Z>Y>W | B.Z>W>X>Y |
| C.Z>X>Y>W | D.Z>Y>X>W |
用石墨作电极电解1 mol/L CuSO4溶液,当c(Cu2+)为0.5 mol/L时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶液恢复至原来状况
| A.CuSO4 | B.CuO | C.Cu(OH)2 | D.CuSO4 5H2O 5H2O |