将1molNa和1molAl的混合物投入足量水中,产生气体在标准状况下的体积为( )
| A.11.2L | B.22.4L | C.33.6L | D.44.8L |
下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是()
①H2O②NH3③F-④CN-⑤
| A.①② | B.①②③④ | C.①②④ | D.①②③④⑤ |
构造原理揭示的电子排布能级顺序,实质是各能级能量高低,若以E表示某能级的能量,下列能量大小顺序中正确的是()
A.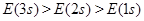 |
B. |
C.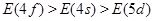 |
D.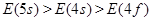 |
关于键长、键能和键角,下列说法不正确的是()
| A.键角是描述分子立体结构的重要参数 |
| B.键长等于两成键原子半径之和 |
| C.键能越大,键长越长,共价化合物越稳定 |
| D.键角的大小与键长、键能的大小无关 |
下列表达式错误的是()
A.甲烷的电子式: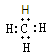 |
B.氮原子的L层电子的电子排布图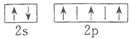 |
C.硫离子的核外电子排布式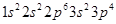 |
D.碳—12原子 |
元素:氦、铷、铯等元素是用下列哪种科学方法发现的()
| A.红外光谱 | B.原子光谱 |
| C.质谱 | D.X射线衍射实验 |