研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式,以下用于研究有机物的方法错误的是( )
| A.蒸馏常用于分离提纯液态有机混合物 |
| B.燃烧法是研究确定有机物成分的有效方法 |
| C.核磁共振氢谱通常用于分析有机物的相对分子质量 |
| D.对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 |
对于可逆反应:mA(g)+nB(g)  xC(g) ΔH=?,在不同温度及压强(p1、p2)条件下,反应物A的转化率如图所示,下列判断正确的是( )
xC(g) ΔH=?,在不同温度及压强(p1、p2)条件下,反应物A的转化率如图所示,下列判断正确的是( )
| A.ΔH>0,m+n>x | B.ΔH>0,m+n<x |
| C.ΔH<0,m+n<x | D.ΔH<0,m+n>x |
在相同温度和压强下,对反应CO2(g)+H2(g) CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
| CO2 |
H2[来源:] |
CO |
H2O |
|
| 甲 |
amol |
amol |
0mol |
0mol[来 |
| 乙 |
2amol |
amol |
0mol |
0mol |
| 丙 |
0mol |
0mol |
amol |
amol |
| 丁 |
amol |
0mol |
amol |
amol |
上述四种情况达到平衡后,n(CO)的大小顺序是( )
A.乙=丁>丙=甲 B.丁>丙>乙>甲 C.丁>乙>丙=甲 D.乙=丁<甲=丙
一定温度下,可逆反应A2(s)+3B2(g)  2AB3(g)达到平衡的标志是()
2AB3(g)达到平衡的标志是()
| A.容器内每减少1mol A2,同时生成2mol AB3 |
| B.容器内每减少1mol A2,同时消耗3mol B2 |
| C.混合气体总的物质的量不变 |
| D.密闭容器内的物质的质量不再改变 |
高温下,某反应达平衡,平衡常数K=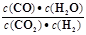 .恒容时,温度升高,H2浓度减小。下列说法正确的是()
.恒容时,温度升高,H2浓度减小。下列说法正确的是()
| A.该反应的焓变为正值 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
| D.该反应化学方程式为CO+H2O=CO2+H2 |
已知H2(g)+I2(g) 2HI(g) ΔH<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
2HI(g) ΔH<0,有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
| A.甲、乙提高相同温度 | B.甲中加入0.1mol He,乙不改变 |
| C.甲降低温度,乙不变 | D.甲增加0.1molH2,乙增加0.1mol I2 |