将太阳能有效地转化为电能是化石燃料耗尽后解决世界能源问题的关键.有人提出以降冰片二烯为介质将太阳能转换为电能的方法:首先让降冰片二烯吸收太阳光转化为其同分异构体四环烷,而后四环烷在催化剂的作用下重新转化为降冰片二烯并放出热量,生成的降冰片二烯循环使用.
(1)降冰片二烯的键线式是 ,其分子式为________.
,其分子式为________.
(2)写出降冰片二烯与H2发生加成反应的化学方程式:________________________________________________________________________.
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为;肼的结构式:
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4(l)反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4(1)△H1= -195kJ·mol-1
②N2H4(1) + O2(g)= N2(g) + 2H2O(g)△H2= -534.2kJ·mol-1
写出N2H4(1)和N2O4(1) 反应生成N2和水蒸气的热化学方程式;
(4)肼一空气燃料电池是一种具有高效,环境友好的碱性电池,,该电池放电时,负极的反应式为。
有A、B、C、D、E四种短周期元素,原子序数依次增大,在周期表中B与C相邻、D与E相邻。已知A原子的电子层数与它的核外电子总数相同。B元素的氢化物与E元素的氢化物反应只生成一种盐;C、D位于同一族,它们能组成DC2、DC3两种常见化合物。请回答下列问题:
(1)C是________ ,D是____________,E是____________。(填元素名称)
(2)由A、B、C中的两种元素组成,且与A2C分子具有相同电子数的两种阳离子是___________ 和 ______________(写化学式)。
(3)D与E可形成共价化合物D2E2,分子中D与E均满足8电子稳定结构,则D2E2的电子式为_________________________________。
(4)A、B、C可以形成一种盐,此盐中A、B、C元素的原子的个数比为4:2:3,该盐的化学式是______。该盐受热可产生B的单质和B的最高价氧化物的水化物,对应化学方程式是____________。
(5)A、B可以形成一种离子化合物,电子式是____________。
(14分)元素周期表中第VIIA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素位置为。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是(填序号)。
a.Cl2、Br2、I2的熔点b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液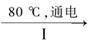 NaClO3溶液
NaClO3溶液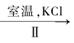 KClO3晶体
KClO3晶体
①已知:I中有可燃气体生成,完成反应的化学方程式______________________。
②II中转化的基本反应类型是,该反应过程能析出KClO3晶体而无其它晶体析出的原因是。
(4)一定条件,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(KJ)相对大小如下图所示。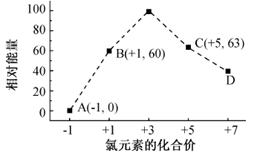
①D是(填离子符号)。
②B→A+C反应的热化学方程式为(用离子符号表示)。
A、B、C、D、E代表5种元素。请填空:
(1) A元素基态原子的最外层有3个未成对电子,次外层有2个电子,写出A元素最外层电子的轨道表示式___________;A元素形成的气态氢化物中A原子的杂化类型为__________;
(2) B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为_______,C的元素符号为______;
(3) D元素的正三价离子的3d亚层为半充满,D的元素符号为_____,其基态原子的电子排布式为_______________。
(4) E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为________,其基态原子的电子排布式为_________________。
水是生命之源,也是一种常用的试剂。请回答下列问题:
(1)水分子中氧原子在基态时核外电子排布式为___ _______;
(2)H2O分子中氧原子采取的是杂化。
(3)水分子容易得到一个H+形成水合氢离子(H3O+)。对上述过程的下列描述不合理的是。
| A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
| C.水合氢离子分子构型是三角锥型 | D.微粒中的键角发生了改变 |
(4)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式:。