设NA为阿伏加德罗常数,下列说法中正确的是( )
| A.1g氢气中所含有的分子数为NA |
| B.0.5moL/L、2L的AlCl3溶液中含有氯离子数为NA |
| C.32g氧气中所含的氧原子数为NA |
| D.1moL/L、500mL的H2SO4溶液中 SO42—的数目为0.5NA |
氢化钙(CaH2)可作为生氢剂,反应的化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑,下列说法不正确的是
| A.CaH2是还原剂,又是氧化剂 |
| B.H2既是氧化产物,又是还原产物 |
| C.CaH2是还原剂,H2O是氧化剂 |
| D.氧化产物与还原产物质量比为1∶1 |
分类方法在化学学科的发展中起到重要的作用。下列分类标准合理的是
| A.根据纯净物中的元素组成,将纯净物分为单质和化合物 |
| B.根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 |
| C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
| D.根据反应中的能量变化,将化学反应分为“化合、分解、复分解、置换”四类 |
下列化学用语表示不正确的是
A.Na+的结构示意图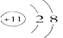 |
B.四氯化碳的电子式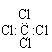 |
| C.二氧化碳的结构式为O=C=O |
| D.乙烯的实验式为 CH2 |
下列关于“物质的量”、“摩尔”和“摩尔质量”的叙述中正确的是
| A.物质的摩尔质量等于其相对分子(原子)质量 |
| B.“物质的量”是国际单位制中的一个基本单位 |
| C.0.012 kg 12C中所含的碳原子数为NA |
| D.1mol任何物质都含有约6.02×1023个原子 |
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。用下图装置加热硫酸铜粉末直至完全分解。若硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如下表所示。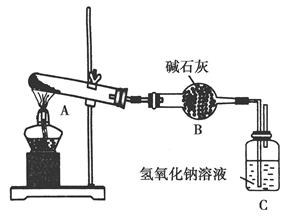
| 装置 |
A(试管+粉末) |
B |
C |
| 反应前 |
42.0 g |
75.0 g |
140.0 g |
| 反应后 |
37.0 g |
79.5 g |
140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是
A.4CuSO4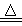 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
B.3CuSO4 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑
C.5CuSO4 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑
D.6CuSO4 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑