下列有关实验中,叙述正确的是
| A.用KMnO4溶液洗气可除去CO2中的SO2 |
| B.用玻璃棒搅拌漏斗中的液体以加快过滤的速度 |
| C.用pH 试纸测溶液pH时,需先用蒸馏水润湿试纸 |
| D.浓硫酸与水混合时,将水慢慢倒入浓硫酸中,边加边搅拌 |
下列反应完成后没有沉淀的是
| A.BaCl2溶液与Na2CO3溶液加足量稀CH3COOH |
| B.Ba(OH)2溶液与KNO3溶液加足量稀H2SO4 |
| C.AgNO3溶液与Na2CO3溶液加足量稀HCl |
| D.AgNO3溶液与FeCl3溶液加足量稀HNO3 |
人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可以作为未来核聚变的重要原料之一。氦的该种核素应表示为( )
A. |
B.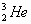 |
C.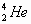 |
D.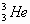 |
设X、Y、Z代表三种元素。已知:
(1)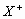 和
和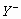 两种离子具有相同的电子层结构;
两种离子具有相同的电子层结构;
(2)Z元素原子核内质子数比Y元素原子核内质子数少9个;
(3)Y和Z两种元素可以形成4核42电子的 价阴离子。
价阴离子。
据此,请填空:
(1)Y元素是___________,Z元素是_____________。
(2)由X、Y、Z三种元素所形成的含68个电子的盐类化合物的化学式是______。
设某元素的一种核素其原子核内的质子数为m,中子数为n,则下列论述中正确的是( )
| A.不能由此确定该元素的相对原子质量 |
B.这种核素的相对原子质量为 |
C.若碳原子的质量为w g,则此原子的质量为 |
D.与 相对原子质量之比为 相对原子质量之比为 |
2001年我国科学家巧妙合成了某超重元素的一种新核素 ,并在世界上首次确认了
,并在世界上首次确认了 缓发裂变先驱核
缓发裂变先驱核 。根据以上信息回答下列问题:
。根据以上信息回答下列问题:
(1) 的中子数为( )
的中子数为( )
A. 105 B. 154 C. 259 D. 364
(2) 的中子数和电子数的差值为( )
的中子数和电子数的差值为( )
A. 105 B. 154 C. 49 D. 259