在室温下,下列叙述正确的是( )
| A.将1 mL 1.0×10-5 mol/L盐酸稀释到1000 mL,得到pH=8 的盐酸 |
| B.将1 mL pH=3的一元酸溶液稀释到10 mL,若溶液的pH<4,则此酸为弱酸 |
| C.用pH=1的盐酸分别中和1 mL pH="13" NaOH溶液和氨水,NaOH消耗盐酸的体积大 |
| D.pH=2的盐酸与pH=1的硫酸比较,2 c(Cl— )=c(SO42— ) |
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
| 酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
| Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从表格中判断以下说法中不正确的是( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4 2H++S
2H++S
D.水对于这四种酸的强弱没有区分能力,但在醋酸中可以区别这四种酸的强弱
一元弱酸HA(aq)中存在下列电离平衡:HA A-+H+。将1.0 mol HA分子加入水中制得1.0 L溶液,下图中,表示溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( )
A-+H+。将1.0 mol HA分子加入水中制得1.0 L溶液,下图中,表示溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( )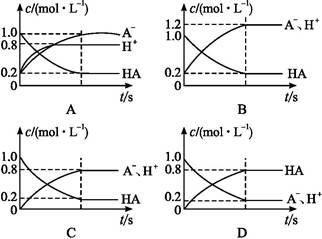
在0.1 mol·L-1的HCN溶液中存在如下电离平衡HCN H++CN-,对该平衡,下列叙述正确的是( )
H++CN-,对该平衡,下列叙述正确的是( )
| A.加入少量NaOH固体,平衡向正反应方向移动 |
| B.加水,平衡向逆反应方向移动 |
| C.滴加少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减少 |
| D.加入少量NaCN固体,平衡向正反应方向移动 |
甲酸的下列性质中,可以证明它是弱电解质的是( )
| A.1 mol·L-1的甲酸溶液的c(H+)为1×10-2 mol·L-1 |
| B.甲酸能与水以任意比互溶 |
| C.10 mL 1 mol·L-1的甲酸溶液恰好与10 mL 1 mol·L-1的NaOH溶液完全反应 |
| D.滴入石蕊试液显红色 |
下列电离方程式正确的是( )
A.NaHSO4 Na++HSO4— Na++HSO4— |
B.NaHCO3 Na++H++CO3— Na++H++CO3— |
C.H3PO4 3H++PO43— 3H++PO43— |
D.HF H++F- H++F- |