为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,
内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的打气球。
(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先除去其中的空气。其中第一步实验操作为: 。从装置的设计看,确定E中空气已被赶尽的实验现象是:______ ________。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为 。有人认为E中收集到的可能是H2而不是NO,如何证明?
(3)实验过程中,发现在未鼓入空气的情况下,E中就产生红棕色。有人认为是由装置E部分设计不当造成的。你认为装置应改进的地方是
。
(4)装置D的作用是 。
将1体积CH4和4体积Cl2组成的混合气体充入大试管中,将此试管倒立在水槽里,放在光亮处。片刻后发现试管中气体颜色,试管中液面上升,试管壁上出现了,在该反应的所有产物中(HCl除外),常温下(填化学式)是气体,空间构型与甲烷完全相同的是(填化学式)。试写出甲烷与氯气反应生成一氯代物的化学反应方程式。
从能量转化的角度看,原电池是一种由_______能转变成________能的装置;用锌片、铜片和稀盐酸组成的原电池,负极是________,正极的电极反应是___________________,正极发生反应(填“氧化”或“还原”)
石油化工排放的废水中常含有多种还原性物质 。向水样中加入稍过量的重铬酸钾标准溶液,充分反应后,再用硫酸亚铁铵标准溶液滴定剩余的重铬酸钾,以检测石油化工废水中还原性物质的含量。
。向水样中加入稍过量的重铬酸钾标准溶液,充分反应后,再用硫酸亚铁铵标准溶液滴定剩余的重铬酸钾,以检测石油化工废水中还原性物质的含量。
⑴配制0.010mo1·L-1标准硫酸亚铁铵溶液500 mL时,需称取硫酸亚铁铵晶体[(NH4 )2Fe(SO4)2·6H2O]的质量为g。
)2Fe(SO4)2·6H2O]的质量为g。
⑵硫酸亚铁铵标准溶液在空气中放置后浓度会发生变化,需用重铬酸钾标准溶液标定硫酸亚铁铵溶液的实际浓度。现取0.0040 mo1·L-1重铬酸钾标准溶液10.00 mL,滴定时,用去25.00 mL硫酸亚铁铵溶液,则硫酸亚铁铵标准溶液的实际浓度为(K2Cr2O7的还原产物为Cr3+)。
⑶实际操作中,检测人员在标定标准硫酸亚铁铵溶液浓度时,每次取浓度值为c的重铬酸钾标准溶液10.0 mL,计算时只要测出滴定中消耗的标准硫酸亚铁铵溶液的体积(V,单位mL)就可以依据一个简单的计算式直接计算出标准硫酸亚铁铵溶液的实际浓度。该计算式为。
学校化学实验室一试剂瓶标签严重破损,只能隐约看到一些信息,如图所示。
(1)该物质(M)分子式为:;
(2)A与M互为同分异构体,B无支链,B与羧酸和醇都能发生酯化反应,A在一定条件下能发生如下转化: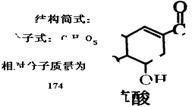

C与F互为同系物,H能使Br2/CCl4溶液褪色,H物质得到的1H-NMR谱中有5个吸收峰。
①A的结构简式为 。
。
②写出一个证明E中官能团的化学方程式 ,反应类型 ;
,反应类型 ;
写出C与D反应生成高聚物的化学方程式,
③写出与H官能团种类和数目都相同的同分异构体任意两个:
针对苏教版化学I第75页上“铁与氧化性较弱的氧化剂(如盐酸、硫酸铜溶液等)反应转化为+2价铁的化合物,如果与氧化性较强的氧化剂(如氯气、双氧水等)反应则转化为+3价的化合物”的叙述,化学研究性学习小组拟通过以下实验探究“新制的还原性铁粉和盐酸的反应(铁过量)”。请你参与探究并回答有关问题: (1)通过简单的化学实验检验反应后混合物中的二价铁的实验方法和现象是;但在实验中往往又看到血红色迅速褪去,同时溶液呈黄色,其可能的原因是:;学生在做实验时往往滴加双氧水的浓度过大,或者过量,还看到迅速产生大量气泡,写出产生该现象的化学方
(1)通过简单的化学实验检验反应后混合物中的二价铁的实验方法和现象是;但在实验中往往又看到血红色迅速褪去,同时溶液呈黄色,其可能的原因是:;学生在做实验时往往滴加双氧水的浓度过大,或者过量,还看到迅速产生大量气泡,写出产生该现象的化学方 程式:。
程式:。 (2)有资料介绍“取少量反应液(含二价铁)先滴加少量新制饱和氯水,然后滴加KSCN溶液,呈现血红色。若再滴加过量新制氯水,却发现血红色褪去。同学对血红色褪去的原因提出各自的假
(2)有资料介绍“取少量反应液(含二价铁)先滴加少量新制饱和氯水,然后滴加KSCN溶液,呈现血红色。若再滴加过量新制氯水,却发现血红色褪去。同学对血红色褪去的原因提出各自的假 设。某同学的假设是:溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式。
设。某同学的假设是:溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式。 (3)探究高铁酸钾的某种性质。
(3)探究高铁酸钾的某种性质。 【实验1】将适量K2FeO4固体分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0 mmol·L-1(1 mmol·L—1 =10—3 mol·L—1)的试样,静置,考察不同初始 pH 的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。
【实验1】将适量K2FeO4固体分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0 mmol·L-1(1 mmol·L—1 =10—3 mol·L—1)的试样,静置,考察不同初始 pH 的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。

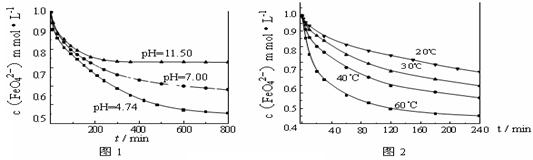

 【实验2】将适量 K2FeO4溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为 1.0 mmol·L-1的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
【实验2】将适量 K2FeO4溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为 1.0 mmol·L-1的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则 ①实验1的目的是;
①实验1的目的是; ②实验2可得出的结论是;
②实验2可得出的结论是; ③高铁酸钾在水
③高铁酸钾在水 中的反应为4 FeO42—+10 H2O
中的反应为4 FeO42—+10 H2O 4 Fe(OH)3+8OH—+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是。
4 Fe(OH)3+8OH—+3 O2↑。由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是。