“碘钟”实验中,3I-+S2O82-===I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃下进行实验,得到 的数据如下表:
| 实验编号 |
① |
② |
③ |
④ |
⑤ |
| c(I-)/mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
| c(S2O82-)/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
| t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t1 |
回答下列问题:
(1)该实验的目的是_____________________________________________________________。
(2)显色时间t1=________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为________(填字母)。
A.<22.0 s B.22.0~44.0 s
C.>44.0 s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是____________________________________
________________________________________________________________________。
(1)下列有关硅单质及其化合物的说法正确的是 。
A.高纯度的硅单质广泛用于制作光导纤维
B.水泥、玻璃、陶瓷都是硅酸盐产品
C.自然界中的硅元素储量丰富,并存在大量的硅单质
D.SiO2属于酸性氧化物,故只与碱溶液发生化学反应,不与任何酸反应
(2)某些化学反应可用下式表示(未配平):A+B→C+D+H2O,请回答下列问题:
①若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,D具漂白性。
A. 写出该反应的离子方程式: 。
B. Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备: MgCl2+2NaClO3=Mg(ClO3)2+2NaCl
MgCl2+2NaClO3=Mg(ClO3)2+2NaCl ,已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
,已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:


将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因: 。
②若A与B加热生成的产物C、D均为无色气体,且C、D两分子中组成元素的原子个数比都为1:2,则符合上式的化学方程式是: 。
③若A为过氧化钠,B为硫酸,则C、D的化学式为 、 。
化合物A只由两种非金属元素组成,A不稳定,一定条件下爆炸生成B、C,以下为相关物质的转化关系,其中B、C、D、J为单质,其中B、D为空气的主要成分,只有J为固体,E为红棕色氧化物固体,反应①、②都是工业生产上的重要反应(部分生成物略),④反应中K过量。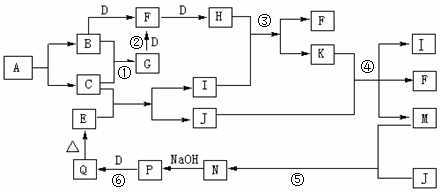
(1)写出反应②的化学反应方程式 。
(2)G的水溶液呈碱性的原因是 。
(3)标况下,将集满H气体的试管倒扣于水槽中,充分反应后所得溶液的物质的量浓度为 。
(4)P→Q反应过程中会观察到的实验现象为 。
(5)如何检验M溶液中阳离子 。
(6)M溶液在强碱性环境下可被KClO溶液氧化制得K2JO4试着写出该反应的离子方程式: 。
在人类社会的发展进程中,金属起着重要的作用。
(1)以下有关金属单质的叙述正确的是。
A.金属钠非常活泼,在实验室中保存在石蜡油或煤油中
B.用坩埚钳夹住一小块铝箔,在酒精灯上加热,可观察到铝箔熔化,并有熔融物滴下
C.铁单质与水蒸气反应的化学方程式为:2Fe+3H2O(g) Fe2O3+3H2
Fe2O3+3H2
(2)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。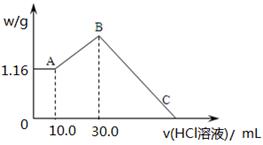
①A点的沉淀物的化学式为 。
②写出A点至B点发生反应的离子方程式: 。
③某溶液中溶有MgCl2和AlCl3两种溶质,若把两者分开,应选用的试剂为: 。
④原混合物中NaOH的质量是 g,C点(此时沉淀恰好完全溶解)HCl溶液的
体积为 mL。
实验室用18.4mol/L的浓硫酸来配制480mL 0.2mol/L的稀硫酸。
(1)所需玻璃仪器除了玻璃棒、烧杯外,还有 。
(2)所需量取浓硫酸的体积为 mL。
(3)下列操作对所配制的稀硫酸浓度有何影响?(用“偏高”“偏低”“无影响”填空)
A.用量筒量取浓硫酸时,洗涤量筒后将洗涤液转移到小烧杯中 。
B.定容时仰视刻度线 。
在过量FeSO4溶液中加入稀硫酸,再滴入几滴NaClO溶液,溶液立即变黄。
(1)上述反应的离子方程式为____________________________。
(2)为检验上述反应中的氧化产物,取少许上述反应后的溶液,加入KSCN溶液,溶液变红,证明氧化产物为Fe3+;为检验上述反应中的还原产物,请填写实验操作、现象和匹配的结论:取少许上述反应后的溶液,______________________________。
(3)为证明上述反应后的溶液中仍存在过量的Fe2+,可向其中滴加_______________溶液。