在海水的综合利用中,海水提溴工业是一个重要组成部分,其中一种提溴的工艺是在预先浓缩并酸化的海水中,通入足量氯气,然后使生成的溴与吸收剂SO2反应转化为氢溴酸以达到富集溴元素的目的。在有关上述工艺流程的以下化学用语中,正确的是
A.用电子式表示溴化氢的形成过程为: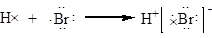 |
B.海水中Br-的电子式为: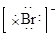 |
| C.海水中通入氯气时发生反应的离子方程式为:2NaBr+Cl2=Br2+2NaCl |
D.氯离子的结构示意图为: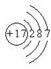 |
已知下列热化学方程式:
Zn(s)+HgO(s)===Hg(l)+ZnO(s) ΔH,则ΔH值为
| A.ΔH2-ΔH1 | B.ΔH2+ΔH1 |
| C.ΔH1-ΔH2 | D.-ΔH1-ΔH2 |
下列叙述正确的是
| A.在原电池的负极和电解池的阴极上都发生失电子的氧化反应 |
| B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2 |
| C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH |
| D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此过程中不发生的化学反应是
| A.4Fe(OH)2 + 2H2O + O2=4Fe(OH)3 |
| B.Fe-2e-=Fe2+ |
| C.2H2O + O2 + 4e-=4OH- |
| D.Fe-3 e-=Fe3+ |
理论上不能设计为原电池的化学反应是
| A.CH4(g)+2O2(g)=CO2(g)+2H2O(1);△H<0 |
| B.HNO3(1)+NaOH(1)=NaNO3(1)+H2O(1);△H<0 |
| C.2H2(g)+O2(g)=2H2O(1);△H<0 |
| D.2FeCl3(1)+Fe(s)=3FeCl2(1);△H<0 |
铜锌原电池(如图所示)是最早被研究的电池。关于该电池的说法中正确的是
| A.铜片是负极 |
| B.锌变成了锌离子 |
| C.电子从铜片经导线流向锌片 |
| D.铜片表面没有气泡 |