下列关于化工生产原理的叙述中,符合实际的是
| A.工业上用NaOH溶液来去除MgCl2酸性溶液中的FeCl3 |
| B.氯气和氢气混合在光照条件下生成氯化氢,用水吸收得到盐酸 |
| C.采用高压条件,增大合成氨反应的化学平衡常数,增大原料转化率 |
| D.用Na2CO3溶液浸泡水垢,实现CaSO4向CaCO3的转化 |
下列关于有机物存在的叙述,错误的是
| A.工业酒精中含有乙醇和甲醇 | B.煤中含有苯和甲苯 |
| C.天然油脂中含有高级脂肪酸甘油酯 | D.许多水果中含有酯类化合物 |
下列化学用语对应正确的是
A.CH4分子的比例模型: |
B.CCl4的电子式: |
| C.H2O2的结构式:H-O-O-H | D.乙酸的最简式:C2H4O2 |
2014年“六·五”世界环境日中国主题为“向污染宣战”,旨在体现对治理污染紧迫性和艰巨性的清醒认识,倡导共同行动,努力改善环境,保卫家园。下列说法正确的是
| A.把硝酸工厂的烟囱建造得更高一些,以减少氮氧化物的排放 |
| B.推广燃煤发电,停建核电站,以防核泄漏事故发生 |
| C.将废电池深埋,可以避免其中的重金属污染 |
| D.大量燃烧化石燃料产生的PM2.5是雾霾天气的主要原因之一 |
手性分子是指在分子结构 中,当a、b、c、d为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。下列分子中指定的碳原子(用★标记)属于手性碳原子的是
中,当a、b、c、d为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。下列分子中指定的碳原子(用★标记)属于手性碳原子的是
A.降冰片烯 |
B.乳酸 |
C.苯甲醇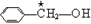 |
D.甘油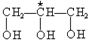 |
25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
| A.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0 |
| D.25 ℃时,该反应的平衡常数K=2.2 |