在恒温、恒容的密闭容器中进行反应A(g) B(g)+C(g)。若反应物的浓度由3 mol·L-1降到1.8 mol·L-1需30 s,那么反应物浓度由0.8 mol·L-1降至0.2 mol·L-1所需反应时间为( )
B(g)+C(g)。若反应物的浓度由3 mol·L-1降到1.8 mol·L-1需30 s,那么反应物浓度由0.8 mol·L-1降至0.2 mol·L-1所需反应时间为( )
| A.15 s | B.大于15 s | C.小于15 s | D.无法判断 |
常温下a mol·L-1稀氨水和b mol·L-1稀盐酸等体积混合,对混合后溶液判断一定正确的是( )
| A.若a=b,则c(NH4+)=c(Cl-) |
| B.若a>b,则c(NH4+)>c(Cl-) |
| C.若a>b,则c(OH-)>c(H+) |
| D.若a<b,则c(OH-)<c(H+) |
一定温度下,水存在H2O H++OH- ΔH=Q(Q>0)的平衡,下列叙述一定正确的是( )
H++OH- ΔH=Q(Q>0)的平衡,下列叙述一定正确的是( )
| A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小 |
| B.将水加热,Kw增大,pH减小 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.向水中加入少量固体硫酸钠,c(H+)=10-7 mol·L-1,Kw不变 |
某温度时,在密闭容器中,X、Y、Z三种气体浓度的变化如图Ⅰ所示,若其它条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图Ⅱ所示。则下列结论正确的是()

A.该反应的热化学方程式为X(g)+3Y(g)  2Z(g) ΔH>0 2Z(g) ΔH>0 |
| B.若其它条件不变,升高温度,正、逆反应速度均增大,X的转化率减小 |
| C.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动 |
| D.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动 |
已知反应①:CO(g)+CuO(s)CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)  Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是()
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是()
A.反应①的平衡常数K1=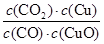 |
| B.反应③的平衡常数K=K1/K2 |
| C.对于反应③,恒容时,若温度升高,H2的浓度减小,则该反应的焓变为正值 |
| D.对于反应③,恒温恒容时,若增大压强,H2的浓度一定减小 |
如下图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+3B(g)  2C(g) ΔH=-192 kJ·mol-1。向M、N中,分别通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是()
2C(g) ΔH=-192 kJ·mol-1。向M、N中,分别通入x mol A和y mol B的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是()
| A.若平衡时A气体在两容器中的体积分数相等,则x一定等于y |
| B.若x∶y=1∶2,则平衡时,M中的转化率:A>B |
| C.若x∶y=1∶3,当M中放出热量172.8 kJ时,A的转化率为90% |
| D.若x=1.2,y=1,N中达到平衡时体积为2 L,含有C 0.4 mol,再通入0.36 mol A时,v正<v逆 |