一定条件下,在体积为3 L的密闭容器中有反应:
CO(g)+2H2(g)  CH3OH(g) (催化剂为Cu2O/ZnO),根据题意完成下列各题:
CH3OH(g) (催化剂为Cu2O/ZnO),根据题意完成下列各题: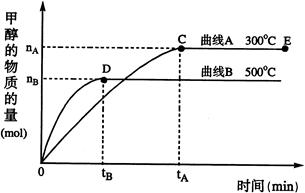
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”);
(2)在500℃,从反应开始到平衡,H2的平均反应速率v(H2)= (用nB、tB表示);
(3)下列描述中能说明上述反应已达平衡的是 ;
a.v(CO)=2v(H2)
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(4)开始向密闭容器中充入0.10 molCO和0.20 molH2,一段时间后达到平衡,测得容器中CH3OH物质的量为0.08 mol;若再通入0.10 molCO和0.20 molH2,则平衡 移动 (填“正向”、“逆向”或“不”);若平衡移动,再次达到平衡后, mol<n(CH3OH)< mol。
按要求写出下列反应的离子方程式。
(1)向NaBr溶液中通入过量Cl2
(2)向次氯酸钙溶液中通入过量CO2
用18.4 mol·L-1的浓硫酸配制100 mL浓度为1 mol·L-1的稀硫酸,其操作可分为以下各步:
| A.用量筒量取5.4 mL浓硫酸,缓慢倒入装有约50 mL蒸馏水的烧杯里,并用玻璃棒搅拌 |
| B.用约30 mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将洗涤液都倒入容量瓶中 |
| C.将稀释后的硫酸小心地倒入容量瓶中 |
| D.检查100 mL容量瓶口是否有漏液现象 |
E.将蒸馏水直接加入容量瓶,至液面距刻度线1~2 cm处
F.盖紧瓶塞,反复颠倒振荡,摇匀溶液
G.用胶头滴管向容量瓶里逐滴加入蒸馏水,至液面最低点与刻度线相切
(1)正确的操作顺序应该是______________________________________________。
(2)进行A步操作的时候,应该选用的是________(填序号)。
①10 mL量筒;②50 mL量筒;③500 mL量筒;④1000 mL量筒
如果对装有浓硫酸的量筒读数如图所示,配制的稀硫酸的浓度将________(填“偏高”、“偏低”或“无影响”)。
(3)进行A步操作后,必须________,才能进行C步操作。
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图,完成下列填空:
(1)与电源负极相连的电极附近,溶液pH值(选填:不变、升高或下降),与电源正极相连的电极叫极,检验该极上产物的方法是。
(2)写出电解饱和食盐水的化学方程式。
(3)如果粗盐中SO 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO ,该钡试剂可以是(选填A.B.c,多选扣分)
,该钡试剂可以是(选填A.B.c,多选扣分)
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(4)判断钡试剂已经过量的方法是。
(5)为有效除去Ca2+、Mg2+、SO ,加入试剂的合理顺序为(选填a,b,c多选扣分)
,加入试剂的合理顺序为(选填a,b,c多选扣分)
A.先加NaOH溶液,后加Na2CO3溶液,再加钡试剂
B.先加NaOH溶液,后加钡试剂,再加Na2CO3溶液
C.先加钡试剂,后加NaOH溶液,再加Na2CO3溶液
(6)为检验精盐纯度,需配制150 mL0.2 mol/LNaCl(精盐)溶液,下图是该同学转移溶液的示意图,图中的错误是。
喷泉是一种常见的实验现象(如下图),其产生原因是存在压强差。
(1)图Ⅰ为化学教学中所用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是(填编号字母)。
A.HCl 和H2O B.O2和H2O
C.SO2和NaOH溶液 D.CO2和NaOH溶液
(2)某学生积极思考产生喷泉的其他办法,并设计了图Ⅱ所示的装置。
在图Ⅱ的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是(填编号字母)。
A.CaCO3和稀H2SO4 B.NaOH与稀HCl
C.Zn与稀HCl D.NaCl与稀HNO3
(3)比较图Ⅰ和图Ⅱ两套装置,从产生喷泉的原理分析,二者的不同点在于。
(4)城市中常见的人造喷泉及火山爆发的原理与上述(填“图Ⅰ”或“图Ⅱ”)装置的原理相似。
在实验室中,氮氧化物废气(主要成分NO2和NO)可以用NaOH溶液来吸收,除去这些废气,其主要反应为:2NO2 +2 NaOH →NaNO2 + NaNO3 + H2O NO + NO2 + 2NaOH → 2NaNO2 + H2O
(1)2molNO和2.4molNO2混合气体通入NaOH溶液被完全吸收时,生成的NaNO2
是_______mol;生成的NaNO3是_______mol 。
(2)NO和NO2的混合气体的组成可表示为NOX ,该混合气体通入NaOH溶液被
完全吸收时,x的值可以为(填编号)。
a.1.1 b.1.2 c.1.5 d.1.8
(3)若用纯碱溶液处理氮氧化物废气,反应与上述类似,同时放出CO2。
请写出纯碱溶液吸收NO2的化学方程式:____________________
(4)现有标准状况下a升NO2(其中N2O4体积分数为20%)和b升NO的混合气恰好被200mL Na2CO3溶液完全吸收,则a、b应满足的关系为:;该Na2CO3溶液的物质的量浓度为 ________mol/L(用含a、b的代数式表示)。
(5)若在标准状况下,2.016 L氮氧化物的混合气和0.896LO2与1mol/LNa2CO3溶液50mL恰好反应生成NaNO3,则混和气体中N2O4与NO2的体积比为。